B
分析:A、根据羟基中有单电子及中性微粒中质子数等于电子数来分析;
B、根据1mol白磷中含有6molP-P共价键来分析;
C、根据阳极Cu-2e═Cu
2+,电解精炼铜事阳极为粗铜来分析;
D、根据3Cu+8HNO
3═3Cu(NO
3)
2+2NO↑+4H
2O及气体是否在标准状况下来分析.
解答:A、1mol羟基(-OH)中含有9mol电子,17gNH
3所含电子为10mol,显然电子数不同,故A错误;
B、12.4g白磷的物质的量为
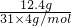
=0.1mol,而1mol白磷中含有6molP-P共价键,则12.4g白磷(分子式为P
4)中含有P-P共价键0.6N
A,故B正确;
C、由Cu-2e═Cu
2+,每转移N
A个电子时,阳极溶解铜的质量为0.5mol×64g/mol=32g,但阳极材料为粗铜,则阳极溶解铜的质量小于32g,故C错误;
D、若为标准状况,由3Cu+8HNO
3═3Cu(NO
3)
2+2NO↑+4H
2O可计算出溶液中氮原子,但不知是否为标准状况,则无法利用NO的体积来计算其物质的量,故D错误;
故选B.
点评:本题考查有关物质的量及阿伏伽德罗常数的计算,明确电子数等于质子数、物质的化学键、电极反应式及电极材料是解答的关键,并注意标况下物质的状态来解答.

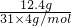 =0.1mol,而1mol白磷中含有6molP-P共价键,则12.4g白磷(分子式为P4)中含有P-P共价键0.6NA,故B正确;
=0.1mol,而1mol白磷中含有6molP-P共价键,则12.4g白磷(分子式为P4)中含有P-P共价键0.6NA,故B正确;

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案