
| A. | 分液、萃取、蒸馏、蒸发 | B. | 萃取、蒸馏、分液、过滤 | ||
| C. | 分液、蒸馏、萃取、过滤 | D. | 蒸馏、萃取、分液、过滤 |
分析 ①氯化钠溶液和四氯化碳的混合液体,分层;
②乙醇与水互溶,但沸点不同;
③碘不易溶于水,易溶于有机溶剂;
④碳酸钙不溶于水.
解答 解:①四氯化碳不溶于水,所以四氯化碳和氯化钠溶液是分层的,可以采用分液的方法分离;
②酒精和水是互溶的两种液体,可以采用蒸馏的方法来分离;
③向氯化钠和单质碘的水溶液中加入萃取剂四氯化碳后,碘单质会溶解在四氯化碳中,四氯化碳和水互不相溶而分层,然后分液即可实现二者的分离;
④碳酸钙不溶于水,可过滤分离.
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意分离方法的应用,题目难度不大.


科目:高中化学 来源: 题型:实验题
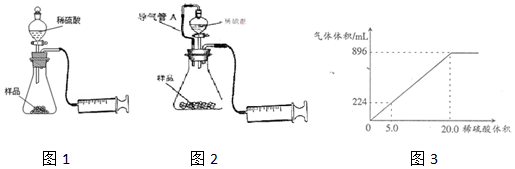
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水宜保存在低温、避光条件下 | |
| B. | H2、I2、HI混合气体加压后颜色变深 | |
| C. | SO2催化氧化成SO3的反应,往往加入过量的空气 | |
| D. | 打开汽水瓶,看到有大量的气泡逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 现有五种物质A、B、C、D、E,分别是稀盐酸、氢氧化钠溶液、铁、碳、二氧化碳中的某一种,D属于酸性氧化物,五种物质间的关系如图,相交叉物质间能发生反应,不相交叉物质间不能发生反应.请回答下列问题:
现有五种物质A、B、C、D、E,分别是稀盐酸、氢氧化钠溶液、铁、碳、二氧化碳中的某一种,D属于酸性氧化物,五种物质间的关系如图,相交叉物质间能发生反应,不相交叉物质间不能发生反应.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
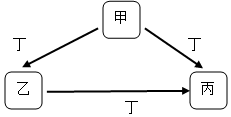 甲、乙、丙、丁均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去).
甲、乙、丙、丁均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与氧气反应 | B. | 盐酸和碳酸氢钠溶液 | ||
| C. | 铜与硝酸反应 | D. | 氯化铝溶液和氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
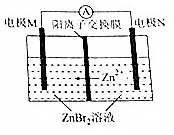 高密度储能电池锌溴电池如图所示,放电时总反应为Zn十Br2═-ZnBr2,下列说法,正确的是( )
高密度储能电池锌溴电池如图所示,放电时总反应为Zn十Br2═-ZnBr2,下列说法,正确的是( )| A. | 放电时,电极N为正极 | |
| B. | 放电时.正极的电极反应式为Br2+2e-═2B- | |
| C. | 充电时,电极M与直流电源的负极相连 | |
| D. | 充电时,Zn2+通过离子交换膜从右向左迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
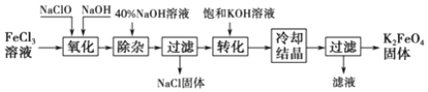
| 化学式 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| Kaq | 8.0×10-16 | 8.0×10-18 | 8.0×10-20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com