
下列离子方程式正确的是
A.鸡蛋壳浸泡在盐酸中产生气泡:CO32-+2H+===CO2↑+H2O
B.四氧化三铁固体溶解在稀硝酸中: Fe3O4+8H+===2Fe3++Fe2++4H2O
C.将氨气通入硫酸溶液中: NH3+H+===NH4+
D.向碳酸氢铵溶液中加入足量的NaOH溶液: NH4++OH-===NH3·H2O
 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案科目:高中化学 来源:2016届江西省高三上学期10月月考化学试卷(解析版) 题型:选择题
下列观点正确的是
A.化合物电离时,生成的阴离子是氢氧根离子的是碱
B.某化合物的熔融状态能导电,该化合物中一定有离子键
C.某化合物的水溶液能导电,该化合物一定是电解质
D.某纯净物在常温下为气体,则组成该物质的微粒一定含有共价键
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高二下期末化学试卷(解析版) 题型:选择题
下列叙述中正确的是
A.同温同压下,相同体积的物质,所含的粒子数必相等
B.任何条件下,等质量的乙烯和一氧化碳所含的分子数必相等
C.1 L一氧化碳气体的质量一定比1 L氧气的质量小
D.等体积、等物质的量浓度的强酸中所含的H+数目一定相等
查看答案和解析>>
科目:高中化学 来源:2016届江西省九江市七校高三第一次联考化学试卷(解析版) 题型:实验题
(14分)亚硝酸钠常用作食品防腐剂。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸的反应及生成气体产物的成分。
已知:①NO+NO2+2OH-===2NO2-+H2O ②气体液化的温度:NO2:21℃、NO:-152℃

(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(按左→右连接):A→C→___→______→B。
(2)组装好仪器后,接下来进行的操作是______.
(3)关闭弹簧夹K1,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体中含有NO,依据的现象是__________。
②装置B的作用是___________,装置E的作用是___________。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为__________。如果没有装置C,对实验结论造成的影响是________。
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三第二次月考化学试卷(解析版) 题型:实验题
(12分)为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g,以下图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)
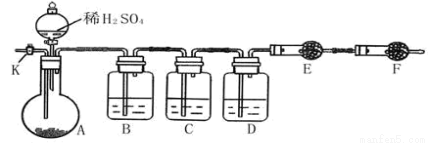
(1)将仪器连接好以后,必须进行的第一步操作是_________ ____。
(2)此实验还必须用到的最重要的仪器是 ;仪器F的作用是 。
(3)已知仪器C中装有品红溶液,其作用是________ _ ___。
(4)实验室中备有以下常用试剂:
a.浓硫酸
b.酸性高锰酸钾溶液
c.品红溶液
d.饱和碳酸氢钠溶液
e.氢氧化钠溶液
f.碱石灰
g.无水硫酸铜
h.五氧化二磷
i.无水氯化钙
①请将下列容器中应盛放的试剂序号填入相应空格:B中______,D中______,E中______。
②实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的空气。这样做的目的是 。所通空气应先经过___________试剂(填上述所供试剂的序号)处理,否则可能引起Na2SO3含量的测量结果比实际值_________(填“偏高”、“偏低”或“没影响”)。
(5)若仪器E在试验完成时增重4.4g,则Na2CO3与Na2SO3的物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源:2016届河南省三门峡市高三上学期第一次精英对抗赛化学试卷(解析版) 题型:选择题
某消毒液的主要成分为NaClO,还含有一定量的NaOH。下列用来解释事实的方程式中,不合理的是(已知:饱和NaClO溶液的pH约为11) ( )
A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-=ClO-+Cl-+H2O
B.该消毒液的pH约为12:ClO-+H2O HClO+OH-
HClO+OH-
C.该消毒液与洁厕灵(主要成分为HCl)混用,产生有毒Cl2:2H++Cl-+ClO-=Cl2↑+H2O
D.该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ClO-=HClO+CH3COO-
查看答案和解析>>
科目:高中化学 来源:2016届福建省福州市高三上学期第二次质量检测考试化学试卷(解析版) 题型:选择题
某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)
A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2 +2OH-=== Cl-+ ClO-+ H2O
B.该消毒液的pH约为12:ClO-+ H2O HClO+ OH-
HClO+ OH-
C.该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl-+ ClO-= Cl2 ↑+ H2O
D.该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+ CH3COO—
查看答案和解析>>
科目:高中化学 来源:2016届西藏日喀则地区一中高三10月月考理综化学试卷(解析版) 题型:实验题
(13分)半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)

已知:
①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。
②PCl3遇水会强烈水解生成H3PO3和HCl;
③PCl3遇O2会生成POCl3,POCl3溶于PCl3。
④PCl3、POCl3的熔沸点如表:
物质 | 熔点/℃ | 沸点/℃ |
PCl3 | -112 | 75.5 |
POCl3 | 2 | 105.3 |
请回答下列问题:
(1)A装置中制氯气的离子方程式为____________。
(2)B中所装试剂是_______;F中碱石灰的作用有两种,分别是______、_______。
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用是_______。
(4)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过_____(填实验操作名称),即可得到较纯净的PCl3。
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为_______。
(6)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3,溶液滴定;
④重复②、③操作,平均消耗Na2S2O3溶液8.40mL。
已知:H3PO3+I2=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,假设测定过程中没有其他反应,该产品中PCl3的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三第四次大考化学试卷(解析版) 题型:选择题
下列实验结论正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 取待测液先进行焰色反应,再加足量稀盐酸,将产生气体通入品红溶液 | 火焰呈黄色,品红溶液褪色 | 原溶液一定是亚硫酸钠溶液 |
B | 向浓醋酸溶液中加入少量碳酸钠溶液,将产生气体通入苯酚钠溶液 | 苯酚钠溶液中出现白色浑浊 | 说明酸性:醋酸>碳酸>苯酚 |
C | 常温下向足量浓度较大的硫酸和稀硫酸中,分别加入相同质量、相同体积的铁片 | 相同时间两者产生H2速率不同[来 | 反应物的浓度越大,反应速率越快 |
D | 相同的铝片分别与同温同体积,且c(H+)=1 mol·L?1的盐酸、硫酸反应 | 铝与盐酸反应产生气泡较快 | 可能是Cl-对该反应起到促进作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com