
20.��������(FeSO4��7H2O)��һ����Ҫ��ʳƷ���������Ӽ���ʵ����ͨ������ʵ���ɷ���м�Ʊ�
FeSO4��7H2O���壺
�� ��5%Na2CO3��Һ���뵽ʢ��һ��������м���ձ��У����������ӣ�����������ȥNa2CO3��Һ��Ȼ����м��ˮϴ��2��3�飻
�� ��ϴ�ӹ��ķ���м�м��������ϡ���ᣬ�����¶���50��80��֮������м�ľ���
�� ���ȹ��ˣ�����Һת�뵽�ܱ������У����á���ȴ�ᾧ��
�� ���ᾧ��Ϻ��˳����壬��������ˮϴ��2��3�Σ�������ֽ���������ɣ�
�� ���Ƶõ�FeSO4��7H2O�������һ��С���ƿ�У��ܱձ��档
��ش��������⣺
�� ʵ�鲽��ٵ�Ŀ����____________________�����ȵ�������__________________��
�� ʵ�鲽������Բ�������������_______________________________��
�� ʵ�鲽�������������ˮϴ�Ӿ��壬��Ŀ����______________��______________��
�� ���������Ϻ��֣����������ڲ�ͬ�¶��½ᾧ�ɷֱ�õ�FeSO4��7H2O��FeSO4��4H2O����FeSO4��H2O�����������ڲ�ͬ�¶��µ��ܽ�Ⱥ��¶������������������±���ʾ������56.7�桢64���¶��¿�ͬʱ�������־��壩��
�����������ܽ�Ⱥ�������������
�¶� /�� | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
�ܽ� ��/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27 | ||
���� ���� | FeSO4��7H2O | FeSO4��4H2O | FeSO4��H2O | |||||||||
����ݱ����������������������ܽ�����ߡ�
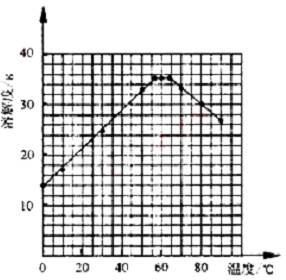
�� ���������������Һ�нᾧ��FeSO4��4H2O��Ӧ���ƵĽᾧ�¶ȣ�t���ķ�ΧΪ________��
�𰸣�
�� ������ �����¶ȣ���Һ������ǿ��ȥ����������ǿ
�� Ӧ����м��������Ӧ����Һ�б�������ʣ�ࣩ��������Һ�п�����Fe3+����
�� ϴ�ӳ�ȥ������渽�ŵ����������
�ñ�ˮϴ�ӿɽ���ϴ�ӹ�����FeSO4��7H2O�����
�� ��ͼ

�� 56.7�棼t��64��
������������Ҫ���������Ʊ���Ӧע������⼰�й��ܽ�ȵļ��㡣
��1������м��մ�����ۣ�������ˮ��ʼ��Ե�Na2CO3��Һ��ȥ���¶����ߣ���Һ������ǿ��ȥ��Ч���ã���һ����Ҫ���ȡ���2������м�ı���һ��������⣨Fe2O3��������м���㣬����Ӧ�����Һ����û��ʣ�ࣩ����������Һ�лẬ��Fe3+����ʹ�Ƶõ�FeSO4��7H2O�������ʢڲ���������3���ھ������Һ�������Ĺ�����һ��Ҫ�����������ӣ�������ˮϴ�ӣ���FeSO4���ܽ�����¶ȵ����߶���������ˮϴ�ӿɼ���FeSO4�������ʧ����4�����ݱ������ݲ��ѻ�������ͼ�ߡ���5�������������ݿ�֪������FeSO4��4H2O���¶ȷ�ΧΪ����56.7 �������64 �档



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
һ������50 kg�Ľ����ˣ�����2 g����2 g���������в����Ե��ʽ���������ʽ���ڣ�������Fe2+��Fe3+����ʽ���ڡ������������ױ����գ���ƶѪ�߲�����ʱ��Ӧ���躬���������ӵĶ������Σ�����������(FeSO4)������ά����C����ʹʳ���е����������ӱ���ԭ�ɶ��������ӣ��������������ա�
��1�������о�������![]() ��ת����A��Fe2+��________����B��Fe3+��________����
��ת����A��Fe2+��________����B��Fe3+��________����
��2��������ά����C����ʹʳ���е����������ӻ�ԭ�ɶ��������ӡ���仰ָ����ά����C����һ��Ӧ����________��������________�ԡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ������50 kg�Ľ����˺���2 g����2 g���������в����Խ������ʵ���ʽ���ڣ�������Fe2+��Fe3+����ʽ���ڡ�����������(��������)�ױ����գ���ƶѪ�߲�����ʱ��Ӧ���躬�������ӵ������Σ�����������(FeSO4)������ά����C������ʹʳ���е�������(����������)����������ӣ��������������ա�
(1)�����о�������Fe2+![]() Fe3+��ת����A��Fe2+?��_________����B��Fe3+��_______����
Fe3+��ת����A��Fe2+?��_________����B��Fe3+��_______����
(2)�ӡ�����ά����C������ʹʳ���е������ӱ���������ӡ���仰������ά����C����һ��Ӧ����______________��������_________________�ԡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
��8�֣��Ķ����в��Ϻش���Ӧ���⡣
һ������50Kg�Ľ����˴�Լ����2g����2g���������в����Ե��ʽ�����ʽ���ڣ�������Fe2+��Fe3+����ʽ���ڡ������������ױ����գ���ƶѪ�߲�����ʱ��Ӧ���躬���������ӵĶ������Σ�����������(FeSO4)������ά����C����ʹʳ���е����������ӻ�ԭ�ɶ��������ӣ��������������ա�
��1�������о����������ת������A�����У�Fe2+�� ������B�����У�Fe3+�� ����
��2��������ά����C����ʹʳ�������������ӻ�ԭ�ɶ��������ӡ�����仰ָ����ά����C����һ��Ӧ���� _�������� �ԡ�
��3����֪:������Cl2 �� Br2 �� Fe3+,��ԭ��Fe2+ ��Br- ��Cl-,����0.2mol/L 1LFeBr2��Һ��ͨ���״��������2.24L,�������������� ���˷�Ӧ�����ӷ���ʽ: ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012��㶫ʡ��ͷ�и�һ��ѧ�����п��Ի�ѧ�Ծ� ���ͣ������
��8�֣� �Ķ����в��Ϻ������Ӧ���⡣
һ������50 kg�Ľ����ˣ�����2 g����2 g���������в��Խ������ʵ���ʽ���ڣ�������Fe2+��Fe3+����ʽ���ڡ�����������(�������ӣ��ױ����գ���ƶѪ�߲�����ʱ��Ӧ���躬�������ӵ������Σ�����������(FeSO4��������ά����C������ʹʳ���е�������(����������)����������ӣ��������������ա�
(1)�����о�������Fe2+ Fe3+��ת����A��Fe2+��__________��B��Fe3+��__________����
Fe3+��ת����A��Fe2+��__________��B��Fe3+��__________����
(2)�ӡ�����ά����C������ʹʳ���е������ӱ���������ӡ���仰������ά����C����һ��Ӧ����__________��������__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��ɽ��ʡ��һ�������¿���ѧ�Ծ� ���ͣ������
��8�֣��Ķ����в��Ϻش���Ӧ���⡣
һ������50Kg�Ľ����˴�Լ����2g����2g���������в����Ե��ʽ�����ʽ���ڣ�������Fe2+��Fe3+����ʽ���ڡ������������ױ����գ���ƶѪ�߲�����ʱ��Ӧ���躬���������ӵĶ������Σ�����������(FeSO4)������ά����C����ʹʳ���е����������ӻ�ԭ�ɶ��������ӣ��������������ա�
��1�������о������� ���ת������A�����У�Fe2+��
������B������Fe3+��
����
���ת������A�����У�Fe2+��
������B������Fe3+��
����
��2��������ά����C����ʹʳ�������������ӻ�ԭ�ɶ��������ӡ�����仰ָ����ά����C����һ��Ӧ���� _�������� �ԡ�
��3����֪:������Cl2 �� Br2 �� Fe3+, ��ԭ��Fe2+ ��Br- ��Cl-,����0.2mol/L 1LFeBr2��Һ��ͨ���״��������2.24L,�������������� ���˷�Ӧ�����ӷ���ʽ: ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com