
| A. | 摩尔质量:mol/g | B. | 物质量:mol | ||
| C. | 溶解度:g/100g | D. | 气体摩尔体积:L/mol |
分析 A.根据表达式M=$\frac{m}{n}$判断摩尔质量的单位;
B.物质的量是基本物理量之一,是微观粒子数目集体的一种物理量,单位为mol;
C.溶解度指一定温度下,100g溶剂能够溶解溶质的最大质量;
D.根据气体摩尔体积的表达式Vm=$\frac{V}{n}$分析.
解答 解:A、摩尔质量表示单位物质的量的物质具有的质量,摩尔质量的常用单位是g/mol,故A正确;
B、物质的量表示微粒数目的集合体,常用单位为mol,故B正确;
C、溶解度指一定温度下,100g溶剂能够溶解溶质的最大质量,单位为g,故C错误;
D.气体摩尔体积是指单位物质的量的气体所占有的体积,单位是L/mol,故D正确;
故选C.
点评 本题考查了常见的物理量相应的单位,题目难度不大,试题侧重基础知识的考查,明确常见物理量的表达式为解答关键,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 侯氏制碱法的工艺过程中主要应用了物质熔沸点的差异 | |
| B. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了分解反应 | |
| C. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于物理变化 | |
| D. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
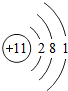 ;铝原子的结构示意图是
;铝原子的结构示意图是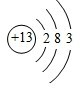 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应是吸热反应 | |
| B. | 化学反应中的能量变化只表现为热量变化 | |
| C. | 当反应物的总能量高于生成物的总能量时,通常发生放热反应 | |
| D. | 当反应物的总能量高于生成物的总能量时,通常发生吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;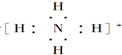 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子间作用力越大,分子越稳定 | |
| B. | 气态氢化物共价键越强,热稳定性越高 | |
| C. | 冰融化时水分子中共价键发生断裂 | |
| D. | 氢键是化学键的一种类型 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com