

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
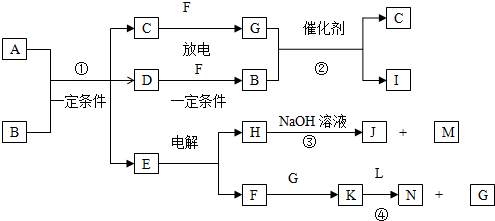

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 1mol甲烷燃烧生成水蒸汽和二氧化碳所放出的热量就是甲烷的燃烧热 | |
| C. | CO(g)的燃烧热△H=-283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)的反应热△H=+566.0kJ/mol | |
| D. | 已知中和热△H=-57.3kJ/mol,则稀H2SO4和Ba(OH)2溶液反应生成2molH2O的反应热△H=-114.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.25mol/L | B. | 2mol/L | C. | 4mol/L | D. | 0.6mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
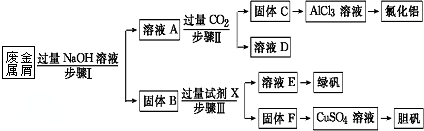
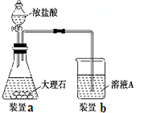 一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少.为了避免固体C减少,可采取的改进措施是在装置I和Ⅱ之间增加一个盛有饱和NaHCO3溶液的洗气瓶
一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少.为了避免固体C减少,可采取的改进措施是在装置I和Ⅱ之间增加一个盛有饱和NaHCO3溶液的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg、Ag | B. | Fe、Zn | C. | Al、Fe | D. | Mg、Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业生产硫酸时,常用NaOH吸收尾气中的少量SO2 | |
| B. | 利用Fe3+作为混凝剂,可以对硬水进行软化 | |
| C. | N2与O2作用生成NO,属于氮的固定 | |
| D. | 石油的分馏、煤的气化或液化都是物理变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com