
【题目】(1)常温下,有pH值为12的NaOH溶液100 mL,欲将其pH值变为11,采取下列三种措施(设混合后溶液的体积等于两混合溶液体积之和)。请回答有关问题:
①若加水,应加入约________ mL。
②若用pH=10的NaOH溶液,应加入此NaOH溶液________ mL。
③若用pH=2的盐酸,应加入________ mL。
(2)pH=2的HA、HB两种酸溶液各1mL,分别加水稀释到1000mL, 其pH的变化如图所示

①稀释前两溶液的浓度c(HA)________c(HB)(填>.<.=,或无法确定)
② HB _______ 是弱酸 (填“一定”、“可能”或“一定不”)
③若 a = 5,则HA酸是否是强酸 ____(填“一定是”、“可能是”、 “一定不是”或“无法确定”)
④稀释后的溶液中,由水电离产生的c(H+): HA中_____ HB中(填>.<.=,或无法确定)
【答案】900 1000 81.8(或900/11) < 一定 一定是 >
【解析】
(1)①pH=12 的NaOH溶液中氢氧根离子浓度是0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度是0.001mol/L,设加入水的体积是V2,c1V1=c2(V1+V2)=0.01mol/L×0.1L=(0.1+V2)L,V2=![]() =0.9L=900mL;
=0.9L=900mL;
②pH=12 的NaOH溶液中氢氧根离子浓度是0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度是0.001mol/L,pH=10的氢氧化钠溶液中氢氧根离子浓度是0.0001mol/L,设加入pH=10的NaOH溶液体积是V2,
c1V1+c2V2=c3(V1+V2)=0.01mol/L×0.1L+0.0001mol/L×V2=0.001mol/L×(0.1+V2),V2=1L=1000mL;
③pH=2的HCl溶液中氢离子浓度是0.01mol/L,设加入盐酸的体积是V,
c(OH-)=![]() =
=![]() =0.001mol/L,V=81.8mL;
=0.001mol/L,V=81.8mL;
(2)pH相同的酸,稀释相同倍数时,酸性强的酸的pH的变化大,酸性较弱的酸的pH的变化小。据此得出酸性:HA>HB;①在稀释前两种酸的pH相同,而两种酸的酸性:HA>HB,故在稀释前两种酸溶液的浓度c(HA)<c(HB);②pH相同的酸,稀释相同倍数时,酸性强的酸的pH的变化大,酸性较弱的酸的pH的变化小,故HA的酸性强于HB的酸性,HB一定是弱酸;③ 若 a = 5,则pH=2的HA酸c(H+)=10-2mol/L,稀释1000倍pH=![]() =10-5mol/L,说明该酸溶液中不存在电离平衡,完全电离,一定是强酸;
=10-5mol/L,说明该酸溶液中不存在电离平衡,完全电离,一定是强酸;
④ 稀释后的溶液中HA中氢离子浓度小于HB中氢离子浓度,对水的电离抑制程度较小,则由水电离产生的c(H+) : HA中>HB中。


科目:高中化学 来源: 题型:
【题目】能源危机当前是一个全球性问题,“开源节流”是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是_____(填字母)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源、不使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。

①在通常状况下,金刚石和石墨相比较,_____填“金刚石”或“石墨”)更稳定,石墨的燃烧热为ΔH=_____。
②12 g石墨在一定量空气中燃烧,生成气体36 g,该过程放出的热量为_________kJ。
(3)已知:N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。N2(g)+O2(g)===2NO(g) ΔH=+180.0 kJ·mol-1。NO分子中化学键的键能为_____。
(4)综合上述有关信息,请写出用CO除去NO的热化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素x、y、d、f的最高正价或最低负价、原子半径的相对大小随原子序数的变化如图所示;短周期元素z、e、g、h的最高价氧化物对应水化物的溶液(浓度均为001mol/L)的pH与原子序数的关系如图所示:

下列有关说法正确的是
A. 离子半径大小顺序:e>f>g>h
B. 由x、z、d三种元素形成的化合物中一定不含离子键
C. y、d、g的简单气态氢化物中沸点最高的是g的氢化物
D. 装满zd2气体的小试管倒扣水槽中充分反应,试管液面上升约2/3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,33.6LN2的物质的量为_____mol,其分子数为_______。
(2)0.4mol某气体的体积为9.8L,则该气体的摩尔体积为____,气体所处的条件____(填“是”或者“不是”)标准状况。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生活中有着广泛的应用,下列说法正确的是( )
A.硅胶可用作袋装食品、瓶装药品的干燥剂
B.在医疗上碳酸钠、Al(OH)3均可用于治疗胃酸过多
C.自来水中加入少量明矾,生成的胶体可以起到杀菌消毒的作用
D.人造刚玉的熔点很高,可用作高级耐火材料,其主要成分是SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的一种重要手段,现有如图所示A~E五种仪器,请根据要求填空。

(1)写出仪器名称:C__________,E_________。
(2)下列实验操作中用到仪器E的是___________(填字母)。
a.分离水和CCl4的混合物
b.分离水和酒精的混合物
c.分离水和泥沙的混合物
d.分离NaCl溶液中的NaCl和水
(3)仪器A~E中使用前必须检查是否漏水的是_________。
(4)若利用下图装置分离四氯化碳和酒精的混合物,则还缺少的仪器是____________,加热前应先在圆底烧瓶中加入几粒沸石,目的是_________________________;冷凝管的进水口是________(填“f”或“g”)。
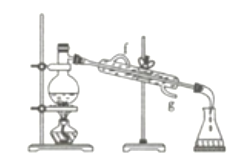
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示a、b都是惰性电极,通电一段时间后,a极附近溶液显红色。下列说法中正确的是( )
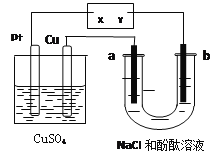
A. X是正极,Y是负极 B. U型管中溶液PH值逐渐变小
C. CuSO4溶液的pH逐渐减小 D. CuSO4溶液的pH保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。请回答钢铁在腐蚀、防护过程中的有关问题。

(1)下列哪个装置可防止铁棒被腐蚀________________。

(2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图。请回答:
①A电极对应的金属是________(写元素名称),B电极的电极反应式是_________________________。
②镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将20g两种金属的混合物投入足量的稀硫酸中,反应完全后得到标准状况下H2 11.2L,则该混合物的组成可能是( )
A. Na和Fe B. Mg和Cu C. Al和Mg D. Zn和Fe
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com