
【题目】中学化学中有很多物质可以实现下图中物质之间的转化。其中反应条件和部分反应的产物已略去。液体B和C可能是单一溶质的溶液,也可能是纯净物。

(1)若A是一种红色金属,气体D能使品红溶液褪色,加热时又恢复原色。写出反应①的化学方程式_______________________________________________。
(2)若A是金属单质,D是一种无色气体,遇到空气变为红棕色,液体C呈浅绿色。
写出反应①的离子方程式________________________________________; 写出反应②的任意一个离子方程式____________________________________________。
(3)若A是一种金属单质,D是最轻的气体,B能否是NaOH溶液________(填“能”或“否”),若能,写出相应的离子方程式 (若否,则不用填此空)__________________________。
【答案】 2H2SO4(浓)+Cu=CuSO4+SO2↑+2H2O 3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O Zn+Fe2+=Fe+Zn2+(或其他合理答案) 否 2Al+2OH-+2H2O=2AlO2-+3H2↑
【解析】(1)若A是一种紫红色金属,应为铜,气体D能使品红溶液褪色,加热时又恢复原色,应为SO2,A和B的反应为铜和浓硫酸在加热条件下的反应,反应的化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;(2)D是一种无色气体,遇到空气变为红棕色,应为NO,液体C呈浅绿色,说明A为Fe,B为稀硝酸,C为Fe(NO3)2,反应①的离子方程式为3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O,反应②为置换反应,生成Fe,离子方程式可写为Zn+Fe2+===Fe+Zn2+等;(3)D是一种无色气体,应为H2,如B为NaOH溶液,则C为NaAlO2,不能发生置换反应生成Al,故答案为:否。
CuSO4+SO2↑+2H2O;(2)D是一种无色气体,遇到空气变为红棕色,应为NO,液体C呈浅绿色,说明A为Fe,B为稀硝酸,C为Fe(NO3)2,反应①的离子方程式为3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O,反应②为置换反应,生成Fe,离子方程式可写为Zn+Fe2+===Fe+Zn2+等;(3)D是一种无色气体,应为H2,如B为NaOH溶液,则C为NaAlO2,不能发生置换反应生成Al,故答案为:否。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)Si(g)+4HCl(g);△H=+Q kJmol﹣1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为Q kJ
C.反应至4min时,若HCl浓度为0.24 mol/L,则H2的反应速率为0.03 mol/(Lmin)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100mL 1molL﹣1的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[选修3—物质结构与性质]
(1)Ⅰ、下列物质的结构或性质与氢键无关的是( )
A.乙醚的沸点
B.乙醇在水中的溶解度
C.氢化镁的晶格能
D.DNA的双螺旋结构
(2)Ⅱ、钒(23V)是我国的丰产元素,广泛用于催化及钢铁工业。
回答下列问题:
(1)钒在元素周期表中的位置为 ,其价层电子排布图为 。
(2) 钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为 。
(3)V2O5常用作SO2转化为SO3的催化剂。SO2分子中S原子价层电子对数是 对,分子的立体构型为 ;SO3气态为单分子,该分子中S原子的杂化轨道类型为 ;SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为 ;该结构中S—O键长由两类,一类键长约140pm,另一类键长约为160pm,较短的键为 (填图2中字母),该分子中含有 个σ键。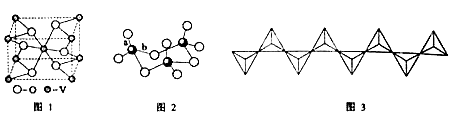
(4) V2O5溶解在NaOH溶液中,可得到钒酸钠(Na2VO4),该盐阴离子的立体构型为 ;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。回答下列问题。
(1)久存的银制器皿表面会变黑,失去银白色的光泽,原因是。
(2)已知,Ksp=(AgCl)=1.8×10-10 , 若向50mL0.018mol/L的AgNO3溶液中加入50mL0.020mol/L的盐酸,混合后溶液中的Ag+的浓度为 mol/L,pH为 。
(3)AgNO3溶液光照易分解,生成Ag和红棕色气体等物质,其光照分解的化学方程式为 。
(4)右图所示原电池正极的反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示,下列说法不正确的是( ) 
A.Z、Y、X的原子半径依次减小,非金属性依次降低
B.Z、Y、W的最高价氧化物对应水化物的酸性依次降低
C.WH4与Z元素的单质在一定条件下可能发生化学反应
D.W的位置是第2周期、第ⅣA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,在试管甲中先加入2 mL 95%的乙醇,在摇动的情况下缓缓加入5 mL浓硫酸,并充分摇匀。冷却后再加入2 g无水CH3COOH,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入7 mL饱和碳酸钠溶液。按图连接好装置。

用酒精灯对试管甲加热,当观察到试管乙中有明显现象时停止实验。
(1)甲试管主要化学反应方程式__________________________。
(2)加入浓硫酸的目的是________、_________。
(3)试管乙中观察到的现象是____________________________。
(4)导气管要在饱和碳酸钠溶液的液面上,不能插入溶液中,其目的是____________。
(5)饱和碳酸钠溶液的作用是(填字母)________。
A.中和浓硫酸
B.中和乙酸并吸收乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com