
| A. | 粗铜与直流电源负极相连 | |
| B. | 相同时间内阳极质量变化与阴极质量变化可能不同 | |
| C. | 硫酸铜溶液浓度始终保持不变 | |
| D. | 杂质Ag以Ag2SO4的形式沉入电解槽形成“阳极泥” |
分析 利用电解法进行粗铜提纯时,粗铜应作阳极,精铜作阴极.阳极与电池的正极相连发生氧化反应,阴极与电池的负极相连发生还原反应,这几种金属的活动性顺序为Zn>Fe>Cu>Ag,因此在电解过程中Ag不会失去电子,而是形成阳极泥,阴极发生反应Cu2++2e-═Cu,开始Zn、Fe放电时,阴极析出的Cu的质量与阳极质量变化不相等,阳极为Cu放电时,两极质量变化相等.根据电荷守恒可知,阴极析出的Cu的物质的量等于阳极消耗金属的物质的量,大于阳极反应的Cu的物质的量,溶液中铜离子浓度减小.
解答 解:A.电解精炼铜时,粗铜应作阳极,与直流电源正极相连,故A错误;
B.金属的活动性顺序为Zn>Fe>Cu>Ag,阳极上Zn、Fe、Cu放电,而阴极发生反应Cu2++2e-═Cu,开始Zn、Fe放电时,阴极析出的Cu的质量与阳极质量变化不相等,故B正确;
C.金属的活动性顺序为Zn>Fe>Cu>Ag,阳极上Zn、Fe、Cu放电,而阴极发生反应Cu2++2e-═Cu,根据电荷守恒可知,阴极析出的Cu的物质的量大于阳极反应的Cu的物质的量,溶液中硫酸铜的浓度减小,故C错误;
D.Ag不放电,以Ag单质形式形式沉入电解槽形成“阳极泥”,故D错误,
故选:B.
点评 本题考查电解原理应用,关键是明确阳极放电顺序,侧重于考查学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:解答题
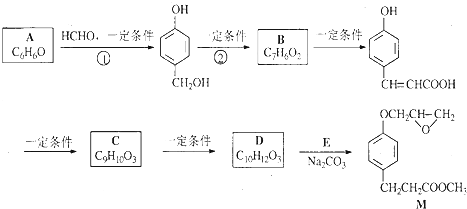
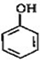 B
B C
C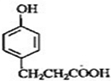
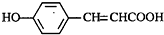 的邻位异构体分子内脱水的反应方程式
的邻位异构体分子内脱水的反应方程式 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O.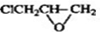 ,写出由D生成M的化学反应方程式
,写出由D生成M的化学反应方程式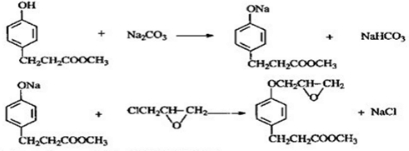 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
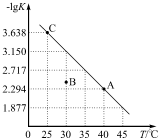 将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,在一定条件下发生下列反应:NH2COONH4(s)?2NH3(g)+CO2(g).该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示.下列说法不正确的是( )
将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,在一定条件下发生下列反应:NH2COONH4(s)?2NH3(g)+CO2(g).该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示.下列说法不正确的是( )| A. | 该反应的△H>0 | |
| B. | 30℃时,B点对应状态的v(正)<v(逆) | |
| C. | A点对应状态的平衡常数K(A)=10-2.294 | |
| D. | NH3的体积分数不变时,该反应一定达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V1=10V2 | B. | V1>10V2 | C. | V1<10V2 | D. | V2>10V1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H | B. | F | C. | Na | D. | Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag2O与CuCl反应的化学方程式为Ag2O+2CuCl═2AgCl+Cu2O | |
| B. | Ag2O溶于稀硝酸的离子方程式为Ag2O+2H+═2Ag++H2O | |
| C. | CuCl可以用铜在氯气中燃烧来制备 | |
| D. | 可以用稀硝酸来鉴别Ag2O与CuCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com