
【题目】亚硝酸钠是一种工业盐,现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
已知:①NO+NO2+2OH-=2NO2-+H2O
②气体液化的温度:NO221℃、NO -152℃

(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接):
A 、C、 、 、 。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是:
。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是 。
②装置E的作用是 。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为 。如果没有装置C,对实验结论造成的影响是 。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是 。
【答案】(1)E、D、B (3分)
(2)防止可能生成的NO被完全氧化成NO2,造成对A中反应气体产物检验不完全(2分)
(3)①D中出现红棕色气体(2分)②冷凝使NO2完全液化(2分)
(4)4NO2+ O2 + 4NaOH = 4NaNO3+2 H2O(2分)
水蒸气存在,会与NO2反应产生NO,造成对NO来源于哪里的认识不清(2分)
(5)2NaNO2+ H2SO4= Na2SO4+ NO2↑ + NO↑+ H2O(2分)
【解析】(1)由于NO2的液化温度高,所以首先检验NO2,即先通过E,然后再通过D。最后需要有尾气处理,即答案是EDB。
(2)空气中的氧气能氧化NO,所以必须先排尽空气,防止可能生成的NO被完全氧化成NO2,造成对A中反应气体产物检验不完全。
(3)①如果有NO,则经过装置E的冷却后,进入D中的气体,能和氧气反应,生成红棕色气体,即现象是D中出现红棕色气体。
②装置E的作用是冷凝使NO2完全液化。
(4)氧气过量,则进入B装置的气体全部是NO2,所以反应的方程式为4NO2+ O2 + 4NaOH = 4NaNO3+2 H2O。如果不干燥气体,则水蒸气存在,会与NO2反应产生NO,造成对NO来源于哪里的认识不清。
(5)根据现象可知,亚硝酸钠与硫酸反应生成物既有NO2,还有NO,所以方程式为2NaNO2+ H2SO4= Na2SO4+ NO2↑ + NO↑+ H2O。


科目:高中化学 来源: 题型:
【题目】工业产生的废气COX、NOX、SOX 对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
(1)已知:CO2(g)+3H2(g) == CH3OH(g)+H2O(l) ΔH=-akJ·mol-1;
2H2(g)+O2(g) == 2H2O(l) ΔH=-bkJ·mol-1;
CH3OH(g) == CH3OH(l) ΔH=-ckJ·mol-1;
则表示CH3OH(l)燃烧热的热化学方程式为:________________________。
(2)光气(COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)![]() COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:

①0~6 min内,反应的平均速率v(Cl2)=__________;
②10min改变的条件是________.
(3)利用氨水可以将SO2和NO2吸收,原理如下左图所示:,NO2被吸收的离子方程式是____________________。


(4)用粗硅作原料,熔融盐电解法制取硅烷原理如上右图,判断B为电源的______极,电解时阳极的电极反应式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,对于可逆反应2A+3B 2C (气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是

A. 若正反应方向ΔH>0,则T1<T 2
B. 由上图可知,A和 B均一定为气体
C. 其它条件不变,压强增大时,混合气体的平均相对分子质量减小
D. 若增大压强,平衡不移动,说明A是气体,B为非气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁发生吸氧腐蚀时,正极发生的电极反应是( )
A. 2H2O+O2+4 e-=4OH-B. Fe2++2e-=Fe
C. 2H++2e-=H2↑D. Fe3++e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积恒定的密闭容器中进行反应A(s)+2B(g) ![]() C(g)+D(g),下列叙述能表明该反应已达到平衡状态的是( )
C(g)+D(g),下列叙述能表明该反应已达到平衡状态的是( )
①混合气体的密度不变 ②容器内气体的压强不变 ③混合气体的总物质的量不变 ④B的物质的量浓度不变 ⑤v正(C)=v逆(D) ⑥容器内物质A的质量 ⑦ v正(B)=v逆(C) ⑧n(B):n(C):n(D)=2:1:1
A. ①④⑤⑥ B. ②③⑥⑦⑧ C. ②④⑤⑥⑧ D. 只有④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铅可用于铅蓄电池、纤维增重剂、涂料分析试剂.工业上通常用自然界分布最广的方铅矿(主要成分为PbS)生产硫酸铅。工艺流程如下:
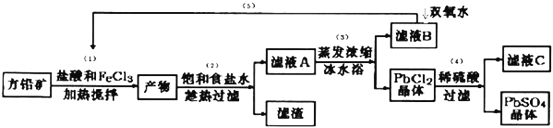
已知:①Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×l0-5.
②PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
③Fe3+、Pb2+以氢氧化物形式开始沉淀时的pH值分别为1.9和7.
(I)流程中加入盐酸可以控制溶液的pH<1.9,主要目的是 _____________________,反应过程中可观察到淡黄色沉淀,则步骤(1)对应的主要反应的离子方程式为 ____________________________;
(II)步骤(2)所得的滤液A 蒸发浓缩后再用冰水浴的目的是___________(请用平衡移动原理解释)
(III)上述流程中可循环利用的物质有___________;
(Ⅵ)步骤(4)中反应的离子方程式为_____________________.对滤液C中氯离子的测定可中和后采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。选用K2CrO4溶液的最好浓度等于 _____________mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
(Ⅴ)PbO2与MnO2性质相似,请写出PbO2与浓盐酸加热条件下反应的离子方程式______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于 Na2 CO3和NaH CO3下列说法不正确的是( )
A.可以用加热的方法除去Na2 CO3中的NaH CO3
B.分别向Na2 CO3和NaH CO3溶液滴加少量盐酸,产生CO2气体较快的为NaH CO3
C.可以用Ca( OH)2 溶液区分Na2 CO3和NaH CO3溶液
D.Na2 CO3比NaH CO3易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱。
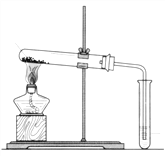
(1)用上图装置分别加热上述两种固体,当观察到澄清石灰水变浑浊时,则试管中受热的固体是_________。通过本实验证明,这两种固体对热的稳定性是Na2CO3 ________于(选填“强”或“弱”)NaHCO3。
(2)若分别向碳酸钠溶液和碳酸氢钠溶液中滴加足量稀盐酸,都能观察到的现象是__________________,其中碳酸氢钠和稀盐酸反应的化学方程式为_______________________________。
(3)钠的化合物中,除了碳酸钠和碳酸氢钠外,还有 _________ 、_________ 等。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com