
【题目】硫和碳及其化合物广泛存在于自然界中,并被人们广泛利用。回答下列问题:
(1)当基态原子的电子吸收能量后,电子会发生____,某处于激发态的S原子,其中1个3s电子跃迁到3p轨道中,该激发态S原子的核外电子排布式为__________。硫所在周期中,第一电离能最大的元素是___________。(填元素符号)
(2)写出一个与CO2具有相同空间结构和键合形式的分子的电子式__________________。
(3)H2S中S原子的杂化类型是__________;H2S的VSEPR模型名称为_________;H2S的键角约为94°,H2O的键角为105°,其原因是___________________________。
(4)科学家通过X射线推测胆矾结构示意图1如下:


其中含有________个配位键,___________个氢键。
(5)已知Zn和Hg同属IIB族元素,火山喷出的岩浆是一种复杂的混合物,冷却时,许多矿物相继析出,其中所含的ZnS矿物先于HgS矿物析出,原因是_________________________________。
(6)碳的另一种同素异形体—石墨,其晶体结构如上图2所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为____个,已知石墨的密度为pg·cm-1,C-C键长为rcm,阿伏伽德罗常数的值为NA,计算石墨晶体的层间距为____cm。
【答案】 跃迁 1s22s22p6 3s13p5 Ar 略 sp3 四面体形 氧与硫同族,硫的电负性更小,对氢原子的吸引力更弱,氢原子离核越远,相应的2根H—S键的成键电子对之间的排斥就更小,所以键角H2S<H2O 4 4 【答题空10】Zn2+比Hg2+离子半径小,ZnS晶格能大于HgS,所以熔点较高,先析出 4 ![]() ρNAr2
ρNAr2
【解析】(1)当基态原子的电子吸收能量后,电子会发生跃迁,激发态的S原子,其中1个3s电子跃迁到3p轨道,该激发态S原子的核外电子排布式为:1s22s22p63s13p5,同周期中从左向右,元素的非金属性增强,第一电离能增强,同周期中稀有气体元素的第一电离能最大,所以在第3周期中,第一电离能最大的元素为Ar,故答案为:跃迁;1s22s22p63s13p5;Ar;
(2)与CO2具有相同空间结构和键合形式的分子可以是二硫化碳,为电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)H2S中S的中心原子中含有2个孤电子对和2个σ键,杂化轨道数2+2=4,硫原子采取sp3杂化;H2S的VSEPR模型名称四面体形,氧与硫同族,硫的电负性更小,对氢原子的吸引力更弱,氢原子离核越远,相应的2根H—S键的成键电子对之间的排斥就更小,所以键角H2S<H2O,故答案为:sp3;四面体形;氧与硫同族,硫的电负性更小,对氢原子的吸引力更弱,氢原子离核越远,相应的2根H—S键的成键电子对之间的排斥就更小,所以键角H2S<H2O;
(4)铜离子与水分子之间形成配位键,水分子之间形成氢键、水分子与硫酸根离子之间也形成氢键,图中微粒中含有 4个配位键,4个氢键,故答案为:4;4;
(5)二者均为离子晶体,Zn2+比Hg2+离子半径小,ZnS晶格能大于HgS,因此ZnS所以熔点较高,先析出,故答案为:Zn2+比Hg2+离子半径小,ZnS晶格能大于HgS,所以熔点较高,先析出;
(6)由图可知石墨的晶胞结构为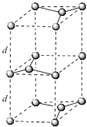 ,设晶胞的底边长为acm,晶胞的高为h cm,层间距为d cm,则h=2d,底面图为
,设晶胞的底边长为acm,晶胞的高为h cm,层间距为d cm,则h=2d,底面图为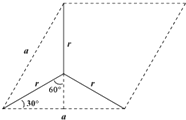 ,则
,则![]() =r×sin60°,可得a=
=r×sin60°,可得a=![]() r,则底面面积为(
r,则底面面积为(![]() r)2×Sin60°,晶胞中C原子数目为1+2×
r)2×Sin60°,晶胞中C原子数目为1+2×![]() +8×
+8×![]() +4×
+4×![]() =4,晶胞质量为
=4,晶胞质量为![]() g,则:ρg·cm-3=
g,则:ρg·cm-3=![]() g÷[(
g÷[(![]() r)2×Sin60°×2d]cm3,整理可得d=
r)2×Sin60°×2d]cm3,整理可得d=![]() ρNAr2,故答案为:4;
ρNAr2,故答案为:4; ![]() ρNAr2。
ρNAr2。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】实验室可利用乙二醇、铜或铜的化合物制备乙二醛,下图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水(加热装置未画出)。请回答下列问题:
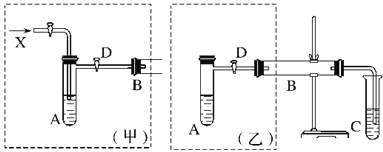
(1)两套装置中的A、B处都需加热,A处用水浴加热。A处用水浴加热的主要优点是____________________________。
(2)若按甲装置进行实验,B管处装铜粉,通入A管的气体为X,B中反应的化学方程式为
_________________________________________________________。
(3)若按乙装置进行实验,则B管中应装___________________________________________,
B中反应的化学方程式为__________________________________________________________。
(4)实验完成时先打开D处的活塞,再撤去酒精灯,这样做的目的是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作的叙述中,正确的是
A. 用苯萃取碘水时,有机层从分液漏斗下口放出
B. 制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中
C. 用50mL的量筒量取6.80mL盐酸
D. 中和滴定实验中,眼睛应注视锥形瓶内溶液颜色的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的恒容密闭容器中发生反应xA(g)+yB(g)![]() zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 ( )
zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 ( )
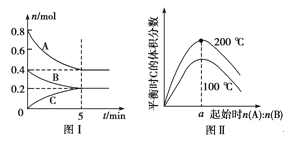
A.图Ⅱ所知反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
B.200 ℃时,反应从开始到平衡的平均速率v(B)=0.02 mol·L-1·min-1
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He的瞬间,v正>v逆
D.200 ℃时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数等于0.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A. lmol FeI2与足量氯气反应时转移的电子数为2NA
B. 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
C. 18gD2O和18gH2O中含有的质子数均为10NA
D. 1 mol Na2O2固体中含离子总数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体正常的血红蛋白含有Fe2+,若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是( )
A. 亚硝酸盐被还原 B. 维生素C是还原剂
C. 维生素C将Fe3+还原为Fe2+ D. 亚硝酸盐与一氧化碳使人中毒的原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率是通过实验测定的,下列化学反应速率的测量中,测量依据不可行的是( )
选项 | 化学反应 | 测量依据(单位时间内) |
A | 2NO2 | 颜色深浅 |
B | Zn+H2SO4=ZnSO4+H2 | H2体积 |
C | CO(g)+H2O(g)=CO2(g)+H2(g) | 压强变化 |
D | Ca(OH)2+Na2CO3=CaCO3↓+2NaOH | 沉淀质量 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属钠的叙述错误的是 ( )
A. 钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+ B. 金属钠用煤油液封于广口玻璃瓶中
C. 钠的质地软,可用小刀切割 D. 实验时用剩的钠块应该放回原试剂瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 1 mol蔗糖可以水解生成2 mol葡萄糖
B. 异戊烷的一氯代物只有一种
C. 明矾溶于水能形成胶体,可用于自来水的杀菌消毒
D. 防伪荧光油墨由颜料与树脂连接料等制成,其中树脂属于有机高分子材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com