
| A. | X>Z>Y>W | B. | Z>W>X>Y | C. | Z>Y>X>W | D. | Z>X>Y>W |
科目:高中化学 来源: 题型:选择题
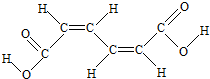
| A. | 已知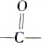 为平面结构,则该有机物分子中最多有16个原子在同一平面内 为平面结构,则该有机物分子中最多有16个原子在同一平面内 | |
| B. | 1mol该有机物可以和2mol NaOH反应,但不能用Na2CO3溶液区分该有机物和CH3COOCH2CH3 | |
| C. | 该有机物能发生加成反应不能发生取代反应 | |
| D. | 该有机物和乙酸互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以铜作阴极、铁作阳极、硫酸铜为电解液可完成铁上镀铜 | |
| B. | 水的电离是吸热过程,升高温度,水的离子积增大、pH减小 | |
| C. | 由反应2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO,可得出C的非金属性强于Si | |
| D. | pH=9的醋酸钠溶液和pH=9的氨水中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
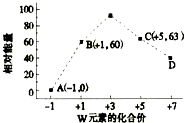 已知前四周期五种元素X、Y、Z、W、T,它们的原子序数依次增大.X是空气中含量最多的元素;Y、W位于同周期,W单质在常温下是黄绿色气体,Y单质在其中燃烧发出黄色火焰;Z的氧化物常用作制备通讯光纤;T是常见金属,在氧气中燃烧可以得到具有磁性的黑色物质.回答下列问题:
已知前四周期五种元素X、Y、Z、W、T,它们的原子序数依次增大.X是空气中含量最多的元素;Y、W位于同周期,W单质在常温下是黄绿色气体,Y单质在其中燃烧发出黄色火焰;Z的氧化物常用作制备通讯光纤;T是常见金属,在氧气中燃烧可以得到具有磁性的黑色物质.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
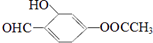 ,下列说法正确的是( )
,下列说法正确的是( )| A. | M的分子式为:C9H8O4 | |
| B. | M与乙酸苯乙酯互为同系物 | |
| C. | M可发生水解反应、加成反应、氧化反应 | |
| D. | 1mol M可与3mol NaOH和2mol Br2发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
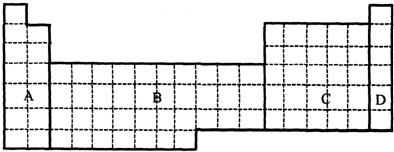
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
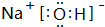 、
、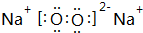 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com