
| A. | 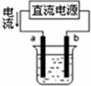 用如图装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 | |
| B. | 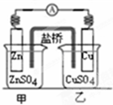 如图装置的盐桥中KCl的Cl-移向乙烧杯 | |
| C. |  如图装置中钢闸门应与外接电源的负极相连获得保护 | |
| D. | 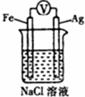 装置中滴入2滴黄色K3[Fe(CN)6]溶液,溶液中可能出现蓝色沉淀 |
分析 A.电解精炼铜,粗铜做阳极,精铜做阴极;
B.盐桥是起到平衡电解质液的电荷守恒,甲池中锌离子增多,氯离子移向甲池;
C.电解阴极被保护;
D.形成原电池反应,为铁的吸氧腐蚀装置.
解答 解:A.电解精炼铜,粗铜做阳极,精铜做阴极,用图装置精炼铜,电流从电源正极流出,则a与正极相连是电解池的阳极,a极为粗铜,电解质溶液为CuSO4溶液,故A正确;
B.盐桥是起到平衡电解质液的电荷守恒,甲池中锌离子增多,氯离子移向甲池;装置盐桥中KCl的Cl-移向甲烧杯,故B错误;
C.装置中钢闸门应与外接电源的负极相连获得保护,电解阴极被保护,故C正确;
D.形成原电池反应,铁为负极,被氧化生成亚铁离子,滴入2滴黄色K3[Fe(CN)6]溶液,溶液中出现蓝色沉淀,故D正确.
故选B.
点评 本题考查了原电池和电解池的工作原理应用,主要考查电解精炼铜、原电池盐桥作用,电解阴极保护的原理,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 10mol氧约含有6.02×1024个氧分子 | |
| B. | NA 约等于6.02×1023 | |
| C. | 摩尔是国际科学界广泛使用的一种物理量 | |
| D. | 摩尔是物质的量的单位,简称摩,符号为mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 以NaCl等为原料制备KClO4的过程如下:
以NaCl等为原料制备KClO4的过程如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com