
| 已知 | 类推 | |
| A | 将Fe加入CuSO4溶液中 Fe+Cu2+═Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+═Cu+2Na+ |
| B | 向稀硫酸加入NaOH溶液至中性 H++OH-═H2O | 向H2SO4溶液加入Ba(OH)2溶液至中性 H++OH-═H2O |
| C | 向次氯酸钙溶液中通入少量CO2 Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO | 向次氯酸钙溶液中通入少量SO2 Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
| D | 向Ca(OH)2溶液中通入过量CO2 CO2+OH-═HCO3- | 向Ca(OH)2溶液中通入过量SO2 SO2+OH-═HSO3- |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Na不能置换出硫酸铜中的Cu;
B.硫酸钡在离子反应中保留化学式;
C.次氯酸钙溶液中通入少量SO2,发生氧化还原反应生成硫酸钙;
D.均发生类似的反应,生成可溶性碳酸氢盐.
解答 解:A.将Na加入到CuSO4溶液中的离子反应为2H2O+2Na+2Cu2+═Cu(OH)2↑+H2↑+2Na+,故A错误;
B.向H2SO4溶液加入Ba(OH)2溶液至中性的离子反应为Ba2++SO42-+2H++2OH-═2H2O+BaSO4↓,故B错误;
C.向次氯酸钙溶液中通入少量SO2的离子反应为Ca2++2ClO-+SO2+H2O═CaSO4↓+H++Cl-+HClO,故C错误;
D.向Ca(OH)2溶液中通入过量CO2的离子反应为CO2+OH-═HCO3-,向Ca(OH)2溶液中通入过量SO2的离子反应为SO2+OH-═HSO3-,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:解答题
 (1)某温度时,在3L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如下图所示.由图中数据分析:
(1)某温度时,在3L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如下图所示.由图中数据分析:| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol•L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol•L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(X)>r(Y)>r(Z)>r(R) | |
| B. | 含有Y、Z、R三种元素的化合物最多只有2种 | |
| C. | 元素R和Y形成的化合物RY2是一种高效安全灭菌消毒剂 | |
| D. | Y与Z形成的两种化合物中的化学键和晶体类型均相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肾功能衰竭等疾病,可利用血液透析进行治疗 | |
| B. | 在饱和氯化铁溶液中滴加NaOH溶液,产生红褐色沉淀 | |
| C. | 清晨,在茂密的树林中,可看到枝叶间透过的一道光线 | |
| D. | 使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78gNa2O2固体中所含离子总数为4NA | |
| B. | 常温常压下,14gN2与CO组成的混合气体含有的原子数为NA | |
| C. | 1molCl2完全反应则转移电子数一定为2NA | |
| D. | Na2O2与水反应产生22.4LO2,则转移电子数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
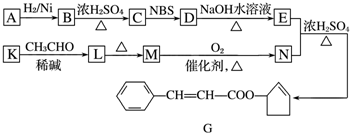
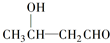
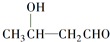 $\stackrel{△}{→}$CH3CH═CHCHO+H2O
$\stackrel{△}{→}$CH3CH═CHCHO+H2O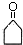 ,G中官能团的名称为碳碳双键和酯基.
,G中官能团的名称为碳碳双键和酯基. ,反应类型加成反应.
,反应类型加成反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将CO2转化为 CH4,既可以减少温室气体的排放,又能得到清洁能源.已知:CO2(g)+2H2O(g)═CH4(g)+2O2(g)△H=+802kJ•mol-1如图为在恒温、光照和不同催化剂(Ⅰ、Ⅱ)作用下,体积为1L的密闭容器中n (CH4)随光照时间的变化曲线.下列说法正确的是( )
将CO2转化为 CH4,既可以减少温室气体的排放,又能得到清洁能源.已知:CO2(g)+2H2O(g)═CH4(g)+2O2(g)△H=+802kJ•mol-1如图为在恒温、光照和不同催化剂(Ⅰ、Ⅱ)作用下,体积为1L的密闭容器中n (CH4)随光照时间的变化曲线.下列说法正确的是( )| A. | 0~16 h内,v(H2O)Ⅰ=1.5 mol/(L•h) | |
| B. | 0~25 h内,催化剂Ⅰ的催化效果比催化剂Ⅱ的效果好 | |
| C. | 在两种不同催化剂下,该反应的平衡常数不相等 | |
| D. | 反应开始后的15h内,第Ⅰ种催化剂的作用下,得到的CH4最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/浓度 | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.8 | 0.975 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com