
| 微粒符号 | 质子数 | 中子数 | 电子数 | 质量数 |
| (1)K | ||||
| (2) | 18 | 20 | ||
| (3) | 16 | 18 | 32 |
 ,画出表中(3)的微粒结构示意图为
,画出表中(3)的微粒结构示意图为 .
. 分析 (1)ZAX在该原子符号中左上角的A表示质量数,左下角的Z表示质子数,结合原子序数=质子数=核电荷数=核外电子数,质量数=质子数+中子数解答;
(2)氩原子核内有18个质子,核外有18个电子;硫离子核内有16个质子,核外有18个电子.
解答 解:(1)质量数为1940K的质量数为40,质子数为19,则中子数为40-19=21,电子数为19;
质子数为18,原子序数为18为Ar,故电子数为18,而中子数为20,所以质量数为38,则为1838Ar;
质量数为32,中子数为16,则质子数为32-16=16;电子数为18,则为1632S2-;
故答案为:
| 微粒符号 | 质子数 | 中子数 | 电子数 | 质量数 |
| (1)1940K | 19 | 21 | 19 | 40 |
| (2)1838Ar | 18 | 20 | 18 | 38 |
| (3)1632S2- | 16 | 16 | 18 | 32 |
 ;
; ;
; ;
; .
.点评 本题考查了原子构成及符号的书写,熟悉质量数、质子数、中子数、电子数之间的关系是解题关键,侧重考查学生对常见化学用语的考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳离子交换树脂 | B. | 阴离子交换树脂 | ||
| C. | 阳离子交换树脂和阴离子交换树脂 | D. | 离子交换树脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
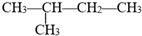 用系统命名法命名的名称是2-甲基丁烷,它的一氯代物有4种,若它是用烯烃和氢气加成而得到,则烯烃可能的结构简式是:CH2=(CH3)C-CH2-CH3;(CH3)2C=CH-CH3;(CH3)2CH-CH=CH2.
用系统命名法命名的名称是2-甲基丁烷,它的一氯代物有4种,若它是用烯烃和氢气加成而得到,则烯烃可能的结构简式是:CH2=(CH3)C-CH2-CH3;(CH3)2C=CH-CH3;(CH3)2CH-CH=CH2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 火力发电厂的煤经粉碎、脱硫处理 | B. | 电镀废液经中和后直接排入到农田 | ||
| C. | 聚乳酸塑料代替传统塑料作购物袋 | D. | 回收并合理处理聚氯乙烯塑料废物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 形成酸雨的主要物质是硫的氧化物和氮的氧化物 | |
| B. | 海洋元素--溴的提取常用“空气吹出法”,该制备方法中溴元素依次经过被氧化、被还原、被氧化的三过程 | |
| C. | 绿色化学的核心就是如何对被污染的环境进行无毒无害的治理 | |
| D. | 水华、赤潮等水体污染主要是由含氮、磷的生活污水任意排放造成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -Y kJ/mol | B. | -(5X-0.5Y)kJ/mol | C. | -(10X-Y)kJ/mol | D. | +(10X-Y)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||||||
| Y | Z | W |
| A. | 工业上电解ZW3饱和溶液冶炼金属Z | |
| B. | 元素X的最高正价与W的最高正价相同 | |
| C. | 简单离子半径的大小顺序:r(X-)<r(Y+) | |
| D. | Y、W的最高价氧化物的水化物均能溶解金属Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com