
| | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 溴化钠溶液(NaI) | 新制氯水、CCl4 | 萃取、分液 |
| B | 氯化铵溶液(FeCl3) | 氢氧化钠溶液 | 过滤 |
| C | 二氧化碳(CO) | 氧化铜粉末 | 通过灼热的氧化铜粉末 |
| D | 碳酸钠(偏铝酸钠) | 盐酸 | 过滤 |
科目:高中化学 来源:不详 题型:单选题
| A.有一澄清的碱性溶液,作离子鉴定时得出的结论是含有:AlO2-、Fe3+、HCO3- |
| B.某一固体溶于水后,检验出含有K+、NO3-、Na+、Cl-等离子, 则该固体混合物是KNO3和NaCl的混合物或KCl和NaNO3的混合物 |
| C.固体NaOH吸收了空气中的二氧化碳并溶于水后,则溶液中含较多的HCO3- |
| D.某溶液中加入BaCl2出现不溶于稀HNO3的白色沉淀,则该溶液中一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
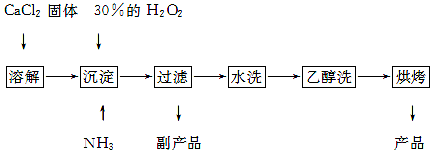
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
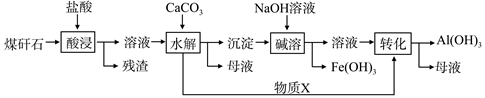
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.分解高锰酸钾制取氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤 |
| B.失去标签的AgNO3溶液、稀盐酸、NaOH溶液、AlCl3溶液可选用(NH4)2CO3溶液作鉴别试剂 |
| C.用铜丝代替铂丝做焰色反应 |
| D.在裂化汽油中加入酸性高锰酸钾,振荡后若紫色褪去即可证明其中含甲苯等苯的同系物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X中一定含有SO42- |
| B | 用铂丝蘸取溶液Y进行焰色反应 | 火焰呈黄色 | 溶液Y中含Na+,不含K+ |
| C | 向一定浓度的Na2SiO3溶液中通入适量CO2气体 | 出现白色沉淀 | H2SiO3的酸性比H2CO3的酸性强 |
| D | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | 析出了NaHCO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
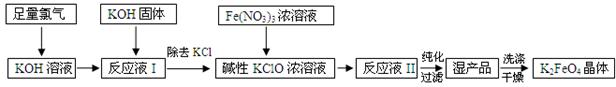
| A.过滤 | B.分液 | C.蒸馏 | D.重结晶 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.丁达尔效应是区分溶液和胶体的一种常用物理方法 |
| B.氯化钠溶液蒸发结晶时,必须将蒸发皿中的液体蒸干才能停止加热 |
| C.实验室可用KOH稀溶液除去NaCl溶液中混有的少量MgCl2杂质 |
| D.测定某溶液的pH,常用干燥洁净的玻璃棒蘸取该溶液滴在润湿的pH试纸上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com