
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核外有13个电子,核内有13个质子 | |
| B. | 质量数为13,原子序数为6,核内有7个质子 | |
| C. | 136C与126C互为同位素 | |
| D. | 质量数为13,质子数为6,中子数为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作和现象 | 结论 |
| A | 室温下,向苯酚钠溶液中通入足量CO2,溶液变浑浊 | 碳酸的酸性比苯酚的强 |
| B | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色 | 溶液中一定含有Fe2+ |
| C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色 | Fe3+的氧化性比I2的强 |
| D | 取少量食盐溶于水,加稀硫酸酸化,再滴入淀粉溶液,溶液未呈蓝色 | 该食盐中不含有碘酸钾 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LSO3所含的氧原子数为1.5NA | |
| B. | 常温常压下,7.8gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8NA | |
| C. | 电解精炼铜时,若阳极质量减少6.4g,则电路中转移电子数为0.2NA | |
| D. | 500ml 1mol/L醋酸溶液中含氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲(电解质):乙、丙、丁(一水合氨、水、盐酸) | |
| B. | 甲(腐蚀品):乙、丙、丁(浓硫酸、烧碱、硝酸) | |
| C. | 甲(有机化合物):乙、丙、丁(甲烷、醋酸钠、乙醛) | |
| D. | 甲(合成高分子材料):乙、丙、丁(光导纤维、涤纶、玻璃) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
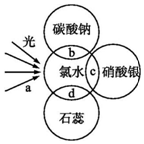 氯水中含有多种成分,因而具有多种性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d中重合部分代表物质间反应,且氯水足量)
氯水中含有多种成分,因而具有多种性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d中重合部分代表物质间反应,且氯水足量)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35Cl 和37Cl 是氯元素的两种核素 | |
| B. | CH3OH可看成是由-CH3和-OH两种官能团组成 | |
| C. | CH3COOCH2CH3和CH3CH2OOCCH3是同种物质 | |
| D. | 金刚石和足球烯互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com