
分析 (1)胶体粒子不能通过半透膜,因为胶粒直径大于半透膜的孔径.毒性粒子能透过透析膜,说明其直径小于透析膜的孔径;
(2)饱和Fecl3溶液因为铁离子的水解呈酸性,加入铝粉产生气泡;接着溶液酸性减弱,的Fe3+水解平衡向正方向进行,生成红褐色氢氧化铁胶体;后来的红褐色沉淀是氢氧化铁沉淀;少量黑色物质是被铝粉还原得到的铁单质.
解答 解:(1)血液可以看作是胶体,胶体不能透过半透膜,该方法是渗析,所以透析的原理与胶体的渗析类似;透析膜同半透膜类似;毒性粒子能通过透析膜,说明透析膜的孔径比毒性粒子的直径大.
故答案为:渗析;半透膜;大于;
(2)①饱和氯化铁溶液因为铁离子的水解呈酸性:Fe3++3H2O=Fe(OH)3+3H+;加入铝粉产生气泡:2Al+6H+=2Al3++3H2↑;溶液酸性减弱,铁离子的水解平衡向正方向进行,生成红褐色Fe(OH)3胶体;胶体聚沉产生的红褐色沉淀是氢氧化铁沉淀;少量黑色物质是被铝粉还原得到的铁单质.
故答案为:Fe(OH)3; Fe(OH)3 ;H2; Fe;
②分离沉淀与溶液的方法为过滤,则除去红褐色溶液中少量沉淀的实验方法是过滤,故答案为:过滤.
点评 本题考查胶体的渗析原理以及Al与饱和Fecl3溶液反应过程.胶体不能透过半透膜;氯化铁是强酸弱碱盐水解溶液呈酸性且铁离子具有极强的氧化性,与铝发生氧化还原反应生成单质铁.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成单质分子的微粒中不一定含有化学键 | |
| B. | 只含有共价键的物质一定是共价化合物 | |
| C. | NaCl溶于水破坏了离子键,乙醇溶于水破坏了共价键 | |
| D. | CaCl2中既有共价键又有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 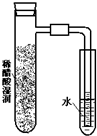 | B. | 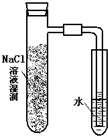 | C. | 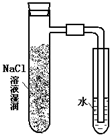 | D. | 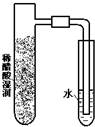 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
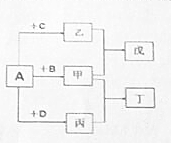 短周期元素a、b、c、d的原子序数依次增大.它们分属于不同主族,这四种元素的原子电子层数之和为8.A、B、C、D依次为a、b、c、d的单质,甲、乙、丙分子内原子数依次为4、3、2.在一定条件下可以发生如图所示的化合反应.
短周期元素a、b、c、d的原子序数依次增大.它们分属于不同主族,这四种元素的原子电子层数之和为8.A、B、C、D依次为a、b、c、d的单质,甲、乙、丙分子内原子数依次为4、3、2.在一定条件下可以发生如图所示的化合反应. ,若将甲通入乙中所得溶液PH大于7,用方程式表示溶液PH大于7 的原因:NH3•H2O?NH4++OH-.
,若将甲通入乙中所得溶液PH大于7,用方程式表示溶液PH大于7 的原因:NH3•H2O?NH4++OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 手持试管给试管里的物质加热 | |
| B. | 用天平称量药品时,用手直接取放砝码 | |
| C. | 用pH试纸测定溶液的酸碱性时,一定要先把试纸用蒸馏水润湿一下 | |
| D. | 两端有大、小两匙的药匙,取用很少量的氧化铜粉末时应用小匙 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
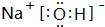 ;酸性最强的是HClO4,呈两性的是Al(OH)3;
;酸性最强的是HClO4,呈两性的是Al(OH)3;查看答案和解析>>
科目:高中化学 来源: 题型:推断题
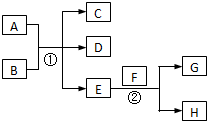 已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略去),请回答下列问题:
已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略去),请回答下列问题: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com