
分析 A、B、C、D、E都是短周期元素,原子序数逐渐增大,A原子的最外层电子数比次外层电子层多3个,原子只能有2个电子层,最外层电子数为5,故A为N元素;E是地壳中含量最高的金属元素,则E为Al;A、B处于同一周期,C、D、E同处另一周期,即A、B处于第二周期,C、D、E处于第三周期,C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,则C是Na元素,B是O元素,甲是Na2O,乙是Na2O2,D的原子序数介于Na、Al之间,故D为Mg,据此答题.
解答 解:A、B、C、D、E都是短周期元素,原子序数逐渐增大,A原子的最外层电子数比次外层电子层多3个,原子只能有2个电子层,最外层电子数为5,故A为N元素;E是地壳中含量最高的金属元素,则E为Al;A、B处于同一周期,C、D、E同处另一周期,即A、B处于第二周期,C、D、E处于第三周期,C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,则C是Na元素,B是O元素,甲是Na2O,乙是Na2O2,D的原子序数介于Na、Al之间,故D为Mg.
(1)由上述分析可知,A、B、C、D的元素符号分别是N、O、Na、Mg,故答案为:N;O;Na;Mg;
(2)D为Mg,处于周期表中第三周期ⅡA族,乙是Na2O2,故答案为:第三周期ⅡA族;Na2O2;
(3)同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:O<N<Al<Mg<Na,故答案为:O<N<Al<Mg<Na;
(4)E的单质为Al,C的最高价氧化物对应的水化物为NaOH,二者反应生成偏铝酸钠与氢气,发生反应的离子方程式是:2Al+2OH-+2H2O═2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(5)A元素的最高价氧化物对应水化物为硝酸,常温下,Al在浓硝酸中发生钝化现象,所以常温下可以用E的单质所制的容器盛放.常温下,Al与稀硝酸反应生成硝酸铝、NO与水,反应离子方程式为:Al+4H++NO3-=Al3++NO↑+2H2O,故答案为:钝化;Al+4H++NO3-=Al3++NO↑+2H2O;
(6)A元素的氢化物为NH3、最高价氧化物对应水化物为HNO3,二者反应方程式为:NH3+HNO3=NH4NO3,反应的现象为:产生白烟,故答案为:产生白烟;NH3+HNO3=NH4NO3.
点评 本题考查位置结构性质关系应用,元素的推断是答题的关键,注意对元素化合物知识的掌握.


科目:高中化学 来源: 题型:选择题
 ,对该合成维生素的叙述正确的是( )
,对该合成维生素的叙述正确的是( )| A. | 该合成维生素有三个苯环 | |
| B. | 该合成维生素1 mol最多能中和5 mol氢氧化钠 | |
| C. | 该合成维生素1 mol最多能和含6 mol单质溴的溴水反应 | |
| D. | 该合成维生素可用有机溶剂萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
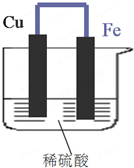 如图所示,将铁、铜通过导线相连,置于稀硫酸中.
如图所示,将铁、铜通过导线相连,置于稀硫酸中.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子晶体都是单质 | |
| B. | 分子晶体在常温下不可能为固态 | |
| C. | 非金属元素的气态氢化物越稳定,其氧化物对应的水化物酸性越强 | |
| D. | 非金属元素的气态氢化物相对分子质量越大,熔沸点不一定越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO可以由Cu和稀硝酸反应制得? | |
| B. | NO不会造成空气污染,是一种无害气体 | |
| C. | NO可以由N2在O2中燃烧制得? | |
| D. | NO是红棕色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 经实验测定等物质的量的盐酸、醋酸分别与足量NaOH溶液反应放出的热量相等 | |
| B. | 中和热测定实验中可以用环形铁丝搅拌棒代替环形玻璃搅拌棒 | |
| C. | 用碱式滴定管量取0.10 mol•L-1的Na2CO3溶液22.10 mL | |
| D. | 用玻璃棒蘸取溶液滴到湿润的广范pH试纸上,测其pH=3.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
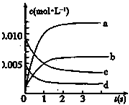 在2L密闭容器内,800℃时反应:2XY (g)+Y2(g)?2XY2(g)体系中,n(XY)随时间的变化如表:
在2L密闭容器内,800℃时反应:2XY (g)+Y2(g)?2XY2(g)体系中,n(XY)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(XY)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:3 | C. | 1:4 | D. | 1:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com