
【题目】图 a 是 1 mol NO2 和 1 mol CO 恰好反应生成 CO2 和 NO 过程中的能量变化示意图;现往体积固定的密闭容器中通入等物质的量的 NO2 和 CO,反应中的 CO 和 NO 的浓度随时间变化的示意图如 b 图。根据图意回答下列问题:
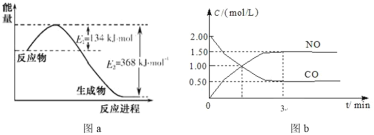
(1)写出 NO2 和CO 反应的热化学方程式__________。
(2)从反应开始到平衡,用 NO2 浓度变化表示平均反应速率 v(NO2)=_________。
(3)此温度下达到平衡时 NO2 的转化率为_________。
(4)830K 时,在密闭容器中发生下列可逆反应CO(g)+H2O(g)CO2(g)+H2(g) △H<0。试回答下列问题:
①若起始时 c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时 CO 的转化率为 60%,则在该温度下,该反应的平衡常数 K=__。
②在相同温度下,若起始时 c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得 H2 的浓度为 0.5mol·L-1,则此时该反应______(填“是”与“否”)达到平衡状态,此时 v(正)_____v(逆)(填“>”、“=”或“<”)。
【答案】NO2 (g) + CO(g) = NO(g) + CO2(g) ΔH =-234 kJ·mol1 ![]() 75% 1 否 >
75% 1 否 >
【解析】
根据焓变等于反应物的活化能-生成物的活化能分析,根据图像求出NO2的改变量,再计算NO2的速率和转化率,通过建立三段式进行计算平衡常数,再计算浓度商来判断是否达到平衡。
(1) NO2 和CO 反应的热化学方程式NO2 (g) + CO(g) = NO(g) + CO2(g) ΔH =134 kJ·mol1-368 kJ·mol1=-234 kJ·mol1;故答案为:NO2 (g) + CO(g) = NO(g) + CO2(g) ΔH =-234 kJ·mol1。
(2)从反应开始到平衡,NO改变量为1.5 molL1,则NO2的改变量为1.5 molL1,用NO2浓度变化表示平均反应速率![]() ;故答案为:
;故答案为:![]() 。
。
(3)由于体积固定的密闭容器中通入等物质的量的 NO 和 CO,CO开始的浓度为2 molL1,平衡时改变量为1.5 molL1,此温度下达到平衡时 NO2的转化率为![]() ;故答案为:75%。
;故答案为:75%。
(4)①若起始时 c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时 CO 的转化率为 60%, ,则在该温度下,该反应的平衡常数
,则在该温度下,该反应的平衡常数 ![]() ;故答案为:1。
;故答案为:1。
②在相同温度下,若起始时 c(CO)=1 molL1,c(H2O)=2 molL1,反应进行一段时间后,测得 H2 的浓度为 0.5 molL1,则此时c(CO2)=0.5 molL1,c(CO)=(1-0.5) molL1=0.5 molL1,c(H2O)= (2-0.5) molL1=1.5 molL1,则此时浓度商![]() ,因此此时该反应没有达到平衡状态,平衡正向移动,因此υ(正) >υ(逆);故答案为:否;>。
,因此此时该反应没有达到平衡状态,平衡正向移动,因此υ(正) >υ(逆);故答案为:否;>。


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)![]() 2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
其中正确的是:
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组依据氧化还原反应:2Ag+(aq)+Cu(s)==Cu2+(aq)+2Ag(s)设计的原电池如图所示,下列说法正确的是
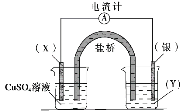
A.电极X可以是碳棒也可以是银棒
B.盐桥中的阳离子流向CuSO4溶液所在烧杯
C.银电极为电池的负极,发生的电极反应为Ag-e-=Ag+
D.外电路中电流的方向是从银电极流向X电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 铜镁合金完全溶解于
铜镁合金完全溶解于![]() 、密度为
、密度为![]() 、质量分数为
、质量分数为![]() 的浓硝酸中,得到
的浓硝酸中,得到![]() 气体
气体![]() 标准状况
标准状况![]() ,向反应后的溶液中加入适量的
,向反应后的溶液中加入适量的![]() 溶液,恰使溶液中的金属离子全部沉淀,下列说法不正确的是
溶液,恰使溶液中的金属离子全部沉淀,下列说法不正确的是![]()
![]()
A.该浓硝酸中HNO3的物质的量浓度是14 mol/L
B.加入NaOH溶液的体积是160 mL
C.起氧化性的硝酸的物质的量为0.16 mol
D.得到的金属氢氧化物的沉淀为6.24 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是()
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是()
A | B | C | D |
|
|
|
|
升高温度,正反应方向平衡常数减小 | 0~3s内,反应速率为:v(NO2)=0.2 mol·L-1·s-1 | t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在 2 L 的密闭容器中,X、Y、Z 三种物质的物质的量随时间的变化曲线如图所示。
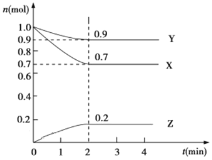
(1)反应从开始至 2 分钟末,Y 的转化率为α(Y)=_______________。
(2)由图中所给数据进行分析,该反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是

A. 正极电极反应式为:2H++2e—→H2↑
B. 此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C. 此过程中铜并不被腐蚀
D. 此过程中电子从Fe移向Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图完成一氧化氮与过氧化钠反应制备亚硝酸钠(2NO+Na2O2=2NaNO2,2NO2+Na2O2=2NaNO3,NO能被酸性KMnO4溶液氧化为NO3-),下列说法错误的是

A.检查装置气密性后,应先打开止水夹,从导管中通入N2
B.装置C是用来吸收CO2的
C.D管中可能含有的杂质为NaNO3、NaOH
D.装置E用于处理尾气,反应中氧化剂与还原剂的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月1日是中华人民共和国成立70周年,国庆期间对大量盆栽鲜花施用了S-诱抗素制剂以保证鲜花盛开,S-诱抗素的分子结构简式如图。下列关于该物质的说法正确的是
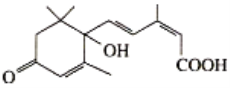
A.该有机物的分子式为C15H20O4
B.该有机物能发生取代、加成和水解反应
C.1mol的该有机物与足量的钠反应产生2molH2
D.1mol该有机物含有4mol双键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com