
 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���٢� | B���ڢ� | C���ۢ� | D���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ɫ | B������ | C����dz | D������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��HClO4 | B��Ba(OH)2 | C��CO2 | D��HF |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Cu(OH)2=Cu2+ + 2 OH�� | B��NH3��H2O NH4+ + OH�� NH4+ + OH�� |
| C��HF= H+ + F�� | D��H3PO4 3 H+ + PO43�� 3 H+ + PO43�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
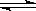 H+ + CH3COO-�Ѵ�ƽ�⣬��Ҫʹ����ĵ���̶Ⱥ���Һ��pH����С��Ӧ������Լ��ǣ� ��
H+ + CH3COO-�Ѵ�ƽ�⣬��Ҫʹ����ĵ���̶Ⱥ���Һ��pH����С��Ӧ������Լ��ǣ� ��| A��CH3COONa | B��NH3��H2O | C��HCl | D��H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ʱ��Һ��c(H+)= 1��10-2mol��L-1 |
| B����Һ��ˮ�������c(H+)= 1��10-12mol��L-1 |
| C��H2O�ĵ���̶����¶����߶����� |
| D��c(H3O +)> c(SO42��) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����25�� 1mL pH=3��HA��Һ��ˮϡ����100mL��ϡ�ͺ���Һ��PH=4 |
| B��HA��Һ��NaHCO3��Һ��Ӧ�ų�CO2 |
| C��25��ʱ��NaA��Һ��pH����7 |
| D����HA��Һ�е�����ȣ���Һ�ʳ�ɫ�����ʺ�ɫ�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com