
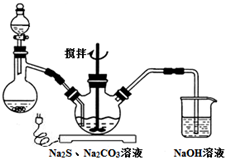
 NaCN为剧毒无机物.某兴趣小组查资料得知,实验室里的NaCN溶液可使用Na2S2O3溶液进行解毒销毁,他们开展了以下三个实验,请根据要求回答问题:
NaCN为剧毒无机物.某兴趣小组查资料得知,实验室里的NaCN溶液可使用Na2S2O3溶液进行解毒销毁,他们开展了以下三个实验,请根据要求回答问题:分析 Ⅰ.(1)以亚硫酸钠、硫化钠和碳酸钠等为原料、采用下述装置制备硫代硫酸钠,根据反应原理可知,蒸馏烧瓶中加入的酸要使反应保持较快的反应速率,浓盐酸、硝酸都易挥发,而稀盐酸加入,反应速率较慢,据此答题;
(2)根据题意,Na2S2O3在酸性条件下会生成S,当溶液中pH接近或不小于7时,如果SO2通过量,会生成NaHSO3,据此书写化学方程式;
(3)从上述生成物混合液中获得较高产率Na2S2O3?5H2O,在混合液中加入活性碳脱色,然后趁热过滤,防止溶液中Na2S2O3?5H2O析出,将除去碳后的滤液进行蒸发浓缩、冷却结晶、抽滤、洗涤、干燥,可得粗晶体,据此答题;
Ⅱ.产品纯度的检测
(4)vmL0.010mol/L碘水溶液中n(I2)=v×10-3L×0.010mol/L=v×10-5mol,根据关系式2Na2 S2O3~I2计算 mg样品中n(Na2 S2O3),根据m=nM计算mg样品中Na2 S2O3•5H2O晶体的质量,据此据此纯度;
(5)A.锥形瓶未用Na2S2O3溶液润洗,对实验结果没影响;
B.用碘水滴定Na2S2O3溶液,锥形瓶中溶液变蓝后立刻停止滴定,进行读数,则加入的碘水的量不足;
C.滴定终点时仰视读数,会使读取的数值偏大;
D.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡,则读出的标准液的体积偏小;
Ⅲ.(6)根据题中实验现象可知,生成的溶液能使 FeCl3溶液呈现血红色,说明有SCN-产生,根据电荷守恒和元素守恒可书写离子方程式.
解答 解:Ⅰ.(1)以亚硫酸钠、硫化钠和碳酸钠等为原料、采用下述装置制备硫代硫酸钠,根据反应原理可知,蒸馏烧瓶中加入的酸要使反应保持较快的反应速率,浓盐酸、硝酸都易挥发,而稀盐酸加入,反应速率较慢,所以用70%的硫酸,故选C;
(2)根据题意,Na2S2O3在酸性条件下会生成S,当溶液中pH接近或不小于7时,如果SO2通过量,会生成NaHSO3,反应的化学方程式为Na2S2O3+SO2+H2O=2NaHSO3+S↓,
故答案为:Na2S2O3+SO2+H2O=2NaHSO3+S↓;
(3)从上述生成物混合液中获得较高产率Na2S2O3?5H2O,在混合液中加入活性碳脱色,然后趁热过滤,防止溶液中Na2S2O3?5H2O析出,将除去碳后的滤液进行蒸发浓缩、冷却结晶、抽滤、洗涤、干燥,可得粗晶体,所以操作①趁热过滤,其目的是:趁热是为了防止晶体在过滤的过程中在漏斗中析出导致产率降低;过滤是为了除去活性炭、硫等不溶性杂质,操作②是蒸发浓缩,冷却结晶,
故答案为:趁热是为了防止晶体在过滤的过程中在漏斗中析出导致产率降低;过滤是为了除去活性炭、硫等不溶性杂质;蒸发浓缩,冷却结晶;
Ⅱ.产品纯度的检测
(4)vmL0.010mol/L碘水溶液中n(I2)=v×10-3L×0.010mol/L=v×10-5mol,则:
2Na2 S2O3~~~~~~~I2
2 1
n(Na2 S2O3) v×10-5mol
所以n(Na2 S2O3)=2×v×10-5mol=2v×10-5mol
Na2 S2O3•5H2O晶体的质量为2v×10-5mol×248g/mol=496v×10-5g.
则该样品纯度为$\frac{496v×10{\;}^{-5}g}{mg}$×100%=$\frac{0.496v}{m}$%,
故答案为:$\frac{0.496v}{m}$%;
(5)A.锥形瓶未用Na2S2O3溶液润洗,对实验结果没影响,故A错误;
B.用碘水滴定Na2S2O3溶液,锥形瓶中溶液变蓝后立刻停止滴定,进行读数,则加入的碘水的量不足,会导致实验结果偏低,故B正确;
C.滴定终点时仰视读数,会使读取的数值偏大,则会使实验结果偏大,故C错误;
D.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡,则读出的标准液的体积偏小,会导致实验结果偏低,故D正确,
故选BD;
Ⅲ.(6)由题中实验现象可知,生成的溶液能使 FeCl3溶液呈现血红色,说明有SCN-产生,根据电荷守恒和元素守恒可知共离子方程式为CN-+S2O32-=SCN-+SO32-,
故答案为:CN-+S2O32-=SCN-+SO32-.
点评 本题通过制取Na2S2O3•5H2O的实验操作,考查了物质制备方案的设计、基本实验操作、物质纯度的计算、滴定误差分析等,题目难度中等,明确实验操作与设计及相关物质的性质是解答本题的关键,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.


 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | 盐酸滴在石灰石上:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 向澄清石灰水中加入盐酸溶液:H++OH-═H2O | |
| C. | 向Ba(OH)2溶液中滴入过量的Na2SO 溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
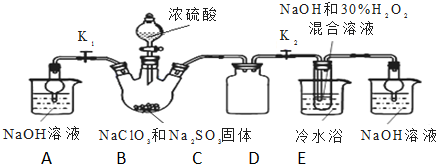
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
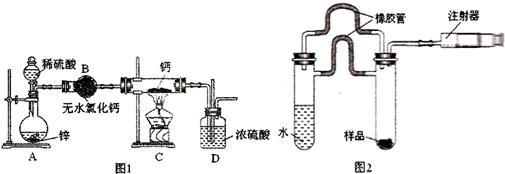
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
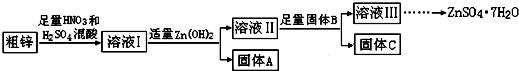
| 物质 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS |
| Ksp | 4.0×10-38 | 5.0×10-20 | 2.0×10-16 | 8.5×10-45 | 1.2×10-23 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化石能源物质内部蕴涵着大量的能量 | |
| B. | 绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来 | |
| C. | 吸热反应中由于反应物总能量小于生成物总能量,因而没有利用价值 | |
| D. | 物质的化学能可以在一定条件下转化为热能.电能为人类所利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
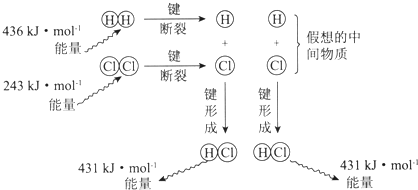
| A. | 该反应的反应热△H=-183kJ•mol-1 | |
| B. | 该反应生成液态HCl比生成气态HCl释放的能量少 | |
| C. | 氯气分子中的化学键比氢气分子中的化学键更稳定 | |
| D. | 1 mol HCl分子中的化学键形成时吸收431kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | 0.60 | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正>ν逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两溶液的导电能力和pH值均相同 | |
| B. | 中和两溶液,消耗NaOH的物质的量相同 | |
| C. | 分别与足量的Zn完全反应,盐酸产生的速率快,氢气多 | |
| D. | 当把两种酸各10mL混合后,加10mL 0.1mol•L-1的NaOH,则有c(H+)=c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com