
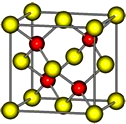
 有A、B、C、D、E五种前四周期的元素.A原子核外有1个未成对电子,A+比B原子少一个电子层,B原子得一个电子填入3p轨道后,3p轨道呈全充满状态.C原子的2p轨道有2个未成对电子,D的最高化合价和最低化合价的代数和为4,与C的核电荷数相差8.E位于周期表第12纵列且是六种元素中原子序数最大的.R是由D、E形成的化合物,其晶胞结构如图所示.请回答下列问题:
有A、B、C、D、E五种前四周期的元素.A原子核外有1个未成对电子,A+比B原子少一个电子层,B原子得一个电子填入3p轨道后,3p轨道呈全充满状态.C原子的2p轨道有2个未成对电子,D的最高化合价和最低化合价的代数和为4,与C的核电荷数相差8.E位于周期表第12纵列且是六种元素中原子序数最大的.R是由D、E形成的化合物,其晶胞结构如图所示.请回答下列问题: .
.分析 A、B、C、D、E五种前四周期的元素,
B原子得一个电子填入3p轨道后,3p轨道呈全充满状态,则B是Cl元素;
A原子核外有1个未成对电子,A+比B原子少一个电子层,则A为Na元素;
C原子的2p轨道有2个未成对电子,D的最高化合价和最低化合价的代数和为4,与C的原子序数相差8,则C和D属于同一主族元素,C为O元素、D为S元素;
E位于周期表第12纵行且是六种元素中原子序数最大的,则E是Zn元素,R是由D、E形成的化合物,其晶胞结构如图所示,该晶胞中红色小球个数是4,黄色小球个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,所以其化学式为ZnS,再结合物质结构、元素周期表分析解答.
解答 解:A、B、C、D、E五种前四周期的元素,
B原子得一个电子填入3p轨道后,3p轨道呈全充满状态,则B是Cl元素;
A原子核外有1个未成对电子,A+比B原子少一个电子层,则A为Na元素;
C原子的2p轨道有2个未成对电子,D的最高化合价和最低化合价的代数和为4,与C的原子序数相差8,则C和D属于同一主族元素,C为O元素、D为S元素;
E位于周期表第12纵行且是六种元素中原子序数最大的,则E是Zn元素,R是由D、E形成的化合物,其晶胞结构如图所示,该晶胞中红色小球个数是4,黄色小球个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,所以其化学式为ZnS,
(1)C为O元素、D为S元素,O元素的电负性较大,故答案为:>;
(2)同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,C为O元素位于第VIA族,所以C的第一电离能比它同周期前一族相邻元素的第一电离能小,
故答案为:小;
(3)E是Zn元素,位于周期表第四周期ⅡB族,价层电子排布为3d104s2,故答案为:3d104s2;ⅡB;
(4)化合物A2D为Na2S,为离子化合物,电子式为 ,故答案为:
,故答案为: ;
;
(5)S2Cl2分子中,所有原子最外层均满足8电子稳定结构,则该分子结构式为Cl-S-S-Cl,根据其结构式知,每个M原子价层电子对个数都是4,则M原子采用sp3杂化,S2Cl2是展开书页型结构,Cl-S位于两个书页面内,该物质结构不对称,正负电荷重心不重合,为极性分子,故答案为:sp3;极性;
(6)如果以上分析知,R的化学式为ZnS,该物质是由阴阳离子构成的,属于离子晶体;
该晶胞属于面心立方结构,晶胞的边长=$\root{3}{\frac{m}{ρ}}$cm=$\root{3}{\frac{\frac{4×(65+32)}{{N}_{A}}}{ρ}}$cm=$\root{3}{\frac{388}{ρ{N}_{A}}}$cm,
故答案为:ZnS;$\root{3}{\frac{388}{ρ{N}_{A}}}$.
点评 本题考查了物质结构和性质,涉及晶胞计算、元素周期律、核外电子排布、原子杂化方式判断等知识点,根据晶胞计算公式、元素周期律内涵、构造原理、价层电子对互斥理论分析解答即可,难点是晶胞计算,注意(5)中S2Cl2分子极性判断,为易错点.


科目:高中化学 来源: 题型:解答题
| 反应物 | 溴水 | 酸性KMnO4溶液 | 氢硫酸(H2S溶液) | 滴有酚酞的NaOH溶液 | 石蕊试液 | 品红溶液 |
| 反应现象 | ||||||
| SO2的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序为:rX>rY>rZ>rW>rQ | |
| B. | Z和Q形成的化合物为离子化合物 | |
| C. | 不存在由元素Z与元素W形成的化合物的水溶液 | |
| D. | 元素W的最高价氧化物对应的水化物的酸性比Q的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | n(CH4)/mol | n(H2O)/mol | n(CO)/mol | n(H2)/mol |
| t1 | 0.18 | 0.38 | 0.22 | 0.66 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.| n(SO32-):,n(HSO3-) | 91:9 | 1:1 | 1:91 |
| PH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单阳离子的氧化性:Z>X | |
| B. | 气态氢化物的稳定性:M>Y | |
| C. | 简单离子半径由大到小的顺序是:M>Y>Z | |
| D. | 在X2M与Z2M的溶液中,水的电离程度,前者大于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.80 | B. | 0.85 | C. | 0.90 | D. | 0.93 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com