
100℃时,将0.1molN2O4置于1L密闭容器中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g) 2NO2(g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是
2NO2(g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是
A.N2O4的消耗速率与NO2的生成速率之比为1:2
B.烧瓶内气体的颜色不再加深
C.烧瓶内气体的平均相对分子质量不再变化
D.烧瓶内气体的压强不再变化
科目:高中化学 来源:2016-2017学年山西省高一上月考二化学卷(解析版) 题型:选择题
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,实验室可通过以下反应制得:2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是
A.KClO3发生还原反应
B.H2C2O4在反应中被氧化
C.H2C2O4的氧化性强于ClO2的氧化性
D.1mol ClO2生成,该反应转移的电子数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上期中理化学卷(解析版) 题型:填空题
甲、乙两容器,甲的容积固定,乙的容积可变。在一定温度下,向甲中通入3mol N2和4mol H2,反应达到平衡时,生成NH3的物质的量为amol。
(1)相同温度下,向乙中通入2molNH3,且保持容积与甲相同,当反应达到平衡时,各物质的浓度与甲平衡中相同。起始时乙中还通入了__________mol N2和_________mol H2。
(2)相同温度下,若向乙中通入6mol N2和8mol H2,且保持压强与甲相等,当反应达到平衡时,生成氨的物质的量为b mol,则a∶b___________1∶2;若乙与甲的容积始终相等,达到平衡时,生成氨的物质的量为c mol,则a∶c__________1∶2(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上期中理化学卷(解析版) 题型:选择题
下列溶液加热蒸干后,能析出该溶质固体的是
A.AlCl3 B.KHCO3 C.Fe2(SO4)3 D.NH4HCO3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆哈密二中高二上期中化学试卷(解析版) 题型:选择题
已知2SO2(g)+O2(g) 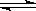 2SO3(g) △H=-197kJ•mol-1.向同温、同体积的三个密闭容器中分别充入气体:(甲) 2mol SO2和1mol O2;(乙) 1mol SO2和0.5mol O2;(丙) 2mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
2SO3(g) △H=-197kJ•mol-1.向同温、同体积的三个密闭容器中分别充入气体:(甲) 2mol SO2和1mol O2;(乙) 1mol SO2和0.5mol O2;(丙) 2mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
A.容器内压强P:P甲=P丙>2P乙
B.SO3的质量m:m甲=m丙>2m乙
C.c(SO2)与c(O2)之比k:k甲=k丙>k乙
D.反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆哈密二中高二上期中化学试卷(解析版) 题型:选择题
下列事实不能用勒夏特列原理解释的是
A.开启啤酒瓶后,瓶中马上泛起大量泡沫
B.钢铁在潮湿的空气中容易生锈
C.实验室中常用排饱和食盐水的方法收集氯气
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆哈密二中高二上期中化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.在化学反应过程中,发生物质变化的同时不一定发生能量变化[来源
B.同温同压下,H2(g)+Cl2(g)= 2HCl(g)在光照和点燃条件下的△H相同
C.生成物的总焓大于反应物的总焓时,反应放热,ΔH<0
D.ΔH的大小与热化学方程式的化学计量数无关
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团二师华山中学高一期中化学卷(解析版) 题型:选择题
下列是某同学对KHSO4的物质类型进行的分析,其中不正确的是
A.根据元素组成知它是化合物
B.因它含有钾离子与酸根离子,故KHSO4是钾盐
C.KHSO4可以称为硫酸氢盐
D.因为它含有与酸相同的元素氢,故KHSO4也可称为酸
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:填空题
雾霾严重影响人们的生活, 雾霾的形成与汽车排放的 NOx等有毒气体有关。
(1)可以通过活性炭处理汽车尾气,原理为:C(s)+2NO(g) N2(g)+CO2 (g) ∆H<0。
N2(g)+CO2 (g) ∆H<0。
①下列情况能说明该反应达到平衡状态的是( )
A.2ν正(NO) =ν逆(CO2)
B.在恒温、恒容的容器中,混合气体的压强保持不变
C.在绝热、恒容的容器中,反应的平衡常数不再变化
D.在恒温、恒压的容器中, 混合气体的密度保持不变
②在恒温、恒容条件下, 加入2 mol C(s)和2 mol NO(g)达平衡后,再在绝热、恒容条件下,加入1 mol NO重新达平衡后, N2的百分含量将____________(填“增大”、“减小”、“不变”)。
(2)臭氧是理想的烟气脱硝试剂,原理为:2NO2(g)+O3(g) N2O5(g)+O2(g)。若在容积为10L的密闭容器中进行该反应,起始时充入0.4 molNO2、0.2 molO3,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
N2O5(g)+O2(g)。若在容积为10L的密闭容器中进行该反应,起始时充入0.4 molNO2、0.2 molO3,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
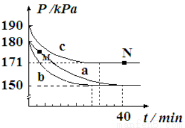
①实验a从开始至平衡时的反应速率v(O3)=_________;实验c中NO2的平衡转化率为___________。
②与实验a相比,其他两组改变的实验条件分别是:b_________,c__________。
③M点的逆反应速率 v(逆)____________N点的正反应速率v(正)(填“>”、“<”或“=”)。
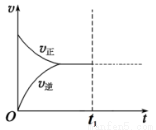
④若在N点时,维持温度和压强不变,t1时再加入0.4 molNO2、0.2 mol O3,请在图中画出逆反应速率在t1后随时间t的变化曲线图。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com