
【题目】前四周期原子序数依次增大的元素A、B、C、D、E中,A的基态原子核外3 个能级上有电子,且每个能级上的电子数相等,B原于核外电子有7 种不同的运动状态,C元素原于核外的M层中只有2对成对电子,D+与C2-的电子数相等,E元素位于元素周期表的ds区,且基态原子价层电子均已成对。
回答下列问题:
(1)E2+ 的价层电子排布图为_____________________。
(2)五种元素中第一电离能最小的是_______________(填元素符号),CAB-离子中,A原子的杂化方式是______________________。
(3)AB-、D+ 和E2+三种离子组成的化学物质D2E(AB)4,其中化学键的类型有_______,该化合物中存在一个复杂离子,该离子的化学式为_________________,配位体是_____________________。
(4)C和E两种元素组成的一种化合物的晶胞如图所示。

①该化合物的化学式为________,E的配位数为______________,C采取_______(填“简单立方”、“体心立方”、“六方最密”或“面心立方最密”)堆积。
②列式表示该晶体的密度:_______________ g·㎝-3。
【答案】 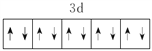 K sp杂化 共价键、配位键、离子键 [Zn(CN)4]2- CN- ZnS 4 六方最密 【答题空10】
K sp杂化 共价键、配位键、离子键 [Zn(CN)4]2- CN- ZnS 4 六方最密 【答题空10】![]()
【解析】本题主要考查物质结构。
前四周期原子序数依次增大的元素A、B、C、D、E中,A的基态原子核外3个能级上有电子,且每个能级上的电子数相等,所以A是碳。B原于核外电子有7种不同的运动状态,所以B是氮。C元素原于核外的M层中只有2对成对电子,所以C是硫。D+与C2-的电子数相等,所以D是钾。E元素位于元素周期表的ds区,且基态原子价层电子均已成对,所以E是锌。
(1)E2+的价层电子排布图为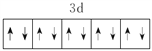 。
。
(2)五种元素中第一电离能最小的是金属性最强的K,CAB-离子中,A原子的价层电子对为2,其杂化方式是sp。
(3) AB-、D+和E2+三种离子组成的化学物质D2E(AB)4,其中化学键的类型有共价键、配位键、离子键,该化合物中存在一个复杂离子,该离子的化学式为[Zn(CN)4]2-,配位体是CN-。
(4)①该化合物的化学式为ZnS,Zn处于4个S原子构成的正四面体中心,E的配位数为4,C采取六方最密堆积。
②晶胞含有一个Zn2+、一个S2-,底面积为![]() a2,晶胞体积为
a2,晶胞体积为![]() a2bpm3,该晶体的密度:
a2bpm3,该晶体的密度: ![]() g·㎝-3。
g·㎝-3。


科目:高中化学 来源: 题型:
【题目】下列反应对应的离子方程式书写正确的是
A. 饱和碳酸钠溶液中通入足量的二氧化碳:2Na++CO32-+CO2+H2O=2NaHCO3↓
B. KIO3与KI在酸性溶液中反应:5I-+IO3-+3H2O═3I2+6OH-
C. 向Al2(SO4)3溶液中加入过量的氨水:Al3++4NH3·H2O═AlO2-+4NH4++2H2O
D. 饱和石灰水与醋酸溶液混合:Ca(OH)2+2CH3COOH=Ca2++2CH3COO-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiAlH4(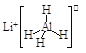 )、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al。下列说法不正确的是
)、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al。下列说法不正确的是
A. LiH与D2O反应,所得氢气的摩尔质量为4 g/mol
B. 1 mol LiAlH4在125℃完全分解,转移3 mol电子
C. LiAlH4溶于适量水得到无色溶液,则化学方程式可表示为:LiAlH4+ 2H2O![]() LiAlO2+ 4H2↑
LiAlO2+ 4H2↑
D. LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用MnO2和浓盐酸反应制取Cl2时,若有0.2molMnO2被还原,则被氧化的HCl为
A.29.2gB.14.6gC.21.9gD.7.3g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两种非金属比较,能说明甲比乙的非金属性强的是( )
①甲比乙更容易与H2化合②甲单质能与乙的阴离子反应,置换出乙单质③甲的气态氢化物比乙的气态氢化物稳定④与某金属反应时甲原子得电子数比乙得的多⑤甲单质的熔沸点比乙的低
A. ④ B. ⑤ C. ①②③ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2﹣二溴乙烷,用16.0g的溴和足量的乙醇制备1,2﹣二溴乙烷,实验结束后得到9.4g产品.实验装置如图所示:
有关数据列表:
乙醇 | 1,2﹣二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/0C | 78.5 | 132 | 34.6 |
熔点/0C | ﹣130 | 9 | ﹣116 |
溶解性 | 易溶水 | 难溶水 | 微溶于水 |
请回答下列问题: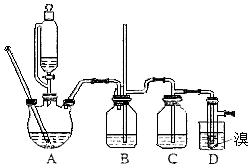
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其主要目的是(填正确选项前的字母;
a、引发反应 b、加快反应速度 c、防止乙醇挥发 d、减少副产物乙醚生成
(2)在装置C中应加入 , 其目的是;(填正确选项前的字母)
a、水 b、浓硫酸 c、氢氧化钠溶液 d、酸性KMnO4溶液
(3)判断该制备反应已经结束的最简单的方法是 .
(4)将1,2﹣二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在层(填“上”或“下”);
(5)在装置B中较长玻璃导管的作用是;
(6)反应过程中应用冷水冷却装置D,其主要目的是 , 但又不能过度冷却(如用冰水),其原因是;
(7)本实验中,1,2﹣二溴乙烷的产率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用的分离操作有:①萃取分液法②结晶法③分液法④蒸馏法⑤过滤法。选择以上方法分离混合物,选择正确的是( )
A. | 饱和食盐水与沙子的混合物 | ①萃取分液法 |
B. | 水和汽油的混合物 | ④蒸馏法 |
C. | 从碘的水溶液里提取碘 | ③分液法 |
D. | 从硝酸钾和氯化钠的混合液中获得硝酸钾 | ②结晶法 |
A.A B.B C.C D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达平衡,平衡常数 ![]() .恒容时,温度升高,H2浓度减小.下列说法正确的是( )
.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2OCO2+H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com