
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g) | K3 | ? | ? |
分析 (1)由表中数据可知,反应②中温度越高,平衡常数越小,说明升高温度平衡向逆反应方向移动;
(2)反应②-反应①得到反应③,则平衡常数K3为反应②与反应①的平衡常数商;
(3)反应①温度越高,平衡常数越大,反应②温度越高,平衡常数越小,而K3=$\frac{K{\;}_{2}}{K{\;}_{1}}$,故反应③温度越高,平衡常数越小,即正反应为放热反应;
(4)加入纯固体平衡不移动,据此分析;
(5)反应①温度越高,平衡常数越大,反应②温度越高,平衡常数越小,而K3=$\frac{K{\;}_{2}}{K{\;}_{1}}$,故反应③温度越高,平衡常数越小,即正反应为放热反应,结合平衡移动原理分析解答;
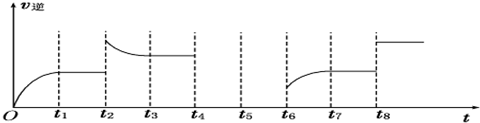
(6)①t2时逆反应速率增大,且平衡时反应速率大于t2时反应速率,平衡向逆反应方向移动,该反应正反应是一个反应前后气体体积不变的吸热反应,不能是升高温度、增大压强,可能是增大生成物的浓度;
t8时反应速率增大,但平衡不移动,该反应正反应是一个反应前后气体体积不变的反应,可能为增大压强或使用催化剂;
解答 解:(1)由表中数据可知,反应②中温度越高,平衡常数越小,说明升高温度平衡向逆反应方向移动,升高温度平衡向吸热反应方向移动,故正反应为放热反应,
故答案为:放热;
(2)反应②-反应①得到反应③,则平衡常数K3为反应②与反应①的平衡常数商,故K3=$\frac{K{\;}_{2}}{K{\;}_{1}}$,
故答案为:$\frac{K{\;}_{2}}{K{\;}_{1}}$;
(3)反应①温度越高,平衡常数越大,反应②温度越高,平衡常数越小,而K3=$\frac{K{\;}_{2}}{K{\;}_{1}}$,故反应③温度越高,平衡常数越小,即正反应为放热反应,所以反应 ③能进行的主要原因是该反应是放热反应,故答案为:该反应是放热反应;
(4)因为铁粉为纯固体,所以反应 ①达到平衡时再加入少量铁粉,平衡将不移动;铁的转化率将减小,故答案为:不移动;减小;
(5)反应①温度越高,平衡常数越大,反应②温度越高,平衡常数越小,而K3=$\frac{K{\;}_{2}}{K{\;}_{1}}$,故反应③温度越高,平衡常数越小,即正反应为放热反应,
A.缩小反应容器的容积,压强增大,反应前后气体体积不变,平衡不移动,故A错误;
B.升高温度,平衡向逆反应方向移动,故B正确;
C.使用合适的催化剂,同等程度加快反应速率,平衡不移动,故C错误;
D.设法减小平衡体系中的CO的浓度,平衡向逆反应方向移动,故D正确;
故选:BD;
(6)①t2时逆反应速率增大,然后逆反应速率减低,且平衡时反应速率大于t2时反应速率,平衡向逆反应方向移动,该反应正反应是一个反应前后气体体积不变的吸热反应,不能是升高温度、增大压强,可能是增大生成物的浓度;
t8时反应速率增大,但平衡不移动,该反应正反应是一个反应前后气体体积不变的反应,可能为增大压强或使用催化剂,
故答案为:增大生成物的浓度;增大压强或使用催化剂.
点评 本题考查化学平衡常数、化学平衡与化学反应速率的影响因素、速率-时间图象等,侧重考查学生的分析能力,题目难度中等.


 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:多选题
| A. | 分子中有C=C双键 | B. | 分子中没有C=C双键 | ||
| C. | 分子可能有C=C双键 | D. | 分子中可能只含单键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电极a表面呈红色 | |
| B. | 电极b作阳极 | |
| C. | 电子由电源的正极沿导线流向电极a | |
| D. | 该装置能量转化形式为电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 适当加热新制的氯水时,溶液的pH逐渐减小 | |
| B. | 加催化剂,使N2和H2在一定条件下转化为NH3 | |
| C. | 可用浓氨水和氢氧化钠固体快速制取氨气 | |
| D. | 增大压强,有利于SO2与O2反应生成SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1>0 | B. | △H4=△H1-△H2-2△H3 | ||
| C. | △H4=△H2-△H1-2△H3 | D. | △H4-△H1-△H2<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com