
【题目】I、某有机物的结构简式如下图所示

试回答:
(1)该有机物的分子式 ,苯环上一氯代物有 种。
(2)含有官能团的名称
(3)1mol该有机物分别与足量的H2、溴水反应需消耗H2 mol,Br2 mol
(4)该有机物与金属钠反应的化学方程式为
(5)该有机物在Cu催化下发生氧化反应的化学方程式为 。
【答案】
(1)C12H18O3 ;2 ;
(2)碳碳双键;羧基;羟基;
(3)6、3 ;
(4) ;
;
(5) 。
。
【解析】
试题分析:(1)根据物质的结构简式可知该有机物的分子式是C12H18O3,在连有3个甲基的苯环上一氯代物有2种;(2) 根据物质的分子结构可知,该物质含有官能团的名称是碳碳双键;羧基;羟基;(3) 该物质的分子中含有的苯环可以与3molH2发生加成反应,与三个碳碳双键可以发生加成反应,消耗3molH2,故1mol该有机物分别与足量的H2需消耗H26mol,单质溴与3个碳碳双键发生加成反应,苯环与不能溴水反应,所以共需消耗Br23mol;(4)醇羟基、羧基都可以与金属钠发生反应,则该有机物与金属钠反应的化学方程式为 ;(5)该有机物在Cu催化下醇羟基可以被氧化变为醛基,发生氧化反应的化学方程式为
;(5)该有机物在Cu催化下醇羟基可以被氧化变为醛基,发生氧化反应的化学方程式为 。
。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】以某菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料通过以下方法可获得碳酸锰粗产品。
(已知:Ksp(MnCO3)=2.2×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp[Al(OH)3]=1.3×10-33,Ksp[Fe(OH)3]=4.0×10-38)
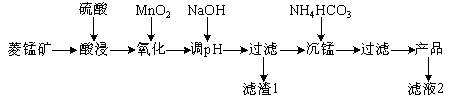
(1)滤渣1中,含铁元素的物质主要是 (填化学式,下同);加NaOH调节溶液的pH约为5,如果pH过大,可能导致滤渣1中 含量减少。
(2)滤液2中,+1价阳离子除了H+外还有 (填离子符号)。
(3)取“沉锰”前溶液a mL于锥形瓶中,加入少量AgNO3溶液(作催化剂)和过量的1.5%(NH4)2S2O8溶液,加热,Mn2+被氧化为MnO,反应一段时间后再煮沸5 min[除去过量的(NH4)2S2O8],冷却至室温。选用适宜的指示剂,用b mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2标准溶液V mL。
①Mn2+与(NH4)2S2O8反应的还原产物为 (填化学式)。
②“沉锰”前溶液中c(Mn2+)= mol·L-1。
(4)其他条件不变,“沉锰”过程中锰元素回收率与NH4HCO3初始浓度(c0)、反应时间的关系如下图所示。

①NH4HCO3初始浓度越大,锰元素回收率越 (填“高”或“低”),简述原因 。
②若溶液中c(Mn2+)=1.0 mol·L-1,加入等体积1.8 mol·L-1 NH4HCO3溶液进行反应,计算20~40 min内v(Mn2+)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示:

(1)该反应的化学方程式是 。
(2)在图上所示的三个时刻中, (填t1、t2或t3)时刻达到化学反应限度。
II.一定温度下将6mol的A及6molB混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g) + 2D(g),经过5分钟后反应达到平衡,测得A的转化率为60﹪,C的平均反应速率是0.36mol/(Lmin)。
xC(g) + 2D(g),经过5分钟后反应达到平衡,测得A的转化率为60﹪,C的平均反应速率是0.36mol/(Lmin)。
求:(1)平衡时D的浓度= mol/L。
(2)B的平均反应速率υ(B)= mol/( L.min)。
(3)x= 。
(4)开始时容器中的压强与平衡时的压强之比为 。(化为最简整数比)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙苯是一种用途广泛的有机原料,可制备多种化工产品。
(一)制备苯乙烯(原理如反应I所示):

(1)部分化学键的键能如下表所示:

根据反应I的能量变化,计算x= ____。
(2)工业上,在恒压设备中进行反应I时,常在乙苯蒸气中通入一定量的水蒸气。用化学平衡理论解释通入水蒸气的原因为____ 。
(3)从体系自由能变化的角度分析,反应I在____(填“高温”或“低温”)下有利于其自发进行。
(二)制备α-氯乙基苯(原理如反应II所示):

(4)T℃时,向10 L恒容密闭容器中充人2mol乙苯(g)和2 mol Cl2(g)发生反应Ⅱ,5 min时达到平衡,乙苯和Cl2、α-氯乙基苯和HCl的物质的量浓度(c)随时间(t)变化的曲线如图l所示:

①0—5 min内,以HCl表示的该反应速率v(HCl)=_____________。
②T℃时,该反应的平衡常数K=_____________。
③6 min时,改变的外界条件为_____________。
④10 min时,保持其他条件不变,再向容器中充人1moI乙苯、1 mol Cl2、1 mol α-氯乙基苯和l mol HCl,12 min时达到新平衡。在图2中画出10-12 min,Cl2和HCl的浓度变化曲线(曲线上标明Cl2和HC1);0—5 min和0—12 min时间段,Cl2的转化率分别用α1、α2表示,则αl α2(填“>”、“<”或“=”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaCl2·xH2O是用途广泛的基础化工产品。我国目前主要是用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2·xH2O,工艺流程如下图所示。

已知:室温时Ksp[Mg(OH)2]=1.8×10-11 , Ksp[Fe(OH)3]=4.0×10-38 ,请回答下列问题:
(1)反应Ⅰ中生成的H2S用足量氨水吸收,一定条件下向所得溶液中通入空气,又可得到单质硫并使吸收液再生,再生反应的化学方程式为_____________________________________。
(2)所得氯化钡粗液中含硫化合物(H2S、HS-等)影响产品质量,可鼓入预热后的空气吹除,预热空气的目的是_______________;沉淀A的主要成分是_______________。
(3)热空气吹除时会有部分HS-转变为S2O O32-,使产品仍达不到纯度要求,可再进行酸化脱硫,酸化脱硫时的离子方程式为______________________________________________________。
(4)室温时,若加碱调溶液pH调至9,则完全沉淀的离子是__________,另一离子浓度为______mol/L (当溶液中离子浓度小于1×10-5 mol/L时认为该离子完全沉淀) 。若向0.1 mol/L FeCl3溶液中加入一定量等浓度的Na2CO3溶液,出现的现象________,发生反应的离子方程式___________________。
(5)将足量的SO2气体通入BaCl2溶液中有无明显现象_____________(填“有”或“无”),向NaOH溶液中通入足量的SO2气体,写出所得溶液离子浓度的大小顺序________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物M(![]() )是一种重要的化工原料,请回答下列问题:
)是一种重要的化工原料,请回答下列问题:
(1)M的分子式为 。
(2)M与H2按物质的量比1:1反应的产物,可能具有的性质是 (填序号)
A.易燃 B.难溶于水 C.可发生加成反应
(3)某耐热型树脂R可由M和丙烯腈(CH2=CHCN)共聚而成。假定按1:1比例反应,试写出R的结构简式: 。
(4)以M为原料合成产品N(![]() )的流程如下(条件略)
)的流程如下(条件略)

则A的结构简式为 ,反应②的发生条件通常是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述中不正确的是
A. 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
B. 28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
C. 常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA
D. 常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E、F和C位于同一主族,F处于第一个长周期。
(1)F原子基态的外围核外电子排布式为______________________________;
(2)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为_______________;
(3)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为_______________;
(4)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为_________;

(5)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NOx、CH2=CHCHO、HCOOH、CH3COONO2(PAN)等二次污染物。
①下列说法正确的是__________________;
A.N2O为直线型分子
B.C、N、O的第一电离能依次增大
C.CH2=CH一CHO分子中碳原子均采用sp2杂化
D.相同压强下,HCOOH沸点比CH3OCH3高,说明前者是极性分子,后者是非极性分子
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H20)5]S04,该配合物中心离子的配体为_____________,其中提供空轨道的是__________________(填微粒符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物克伦特罗(Clenbuterol)结构如下图所示。下列有关克伦特罗的叙述,不正确的是( )

A. 该物质的分子式为C12H18ON2Cl2
B. 该物质易溶于盐酸
C. 该物质的1H核磁共振谱图中有8个吸收峰
D. 该物质能发生的类型有:加成反应、酯化反应、消去反应、氧化反应等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com