
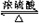 CH3COOC2H5+H2O;③
CH3COOC2H5+H2O;③ .
.
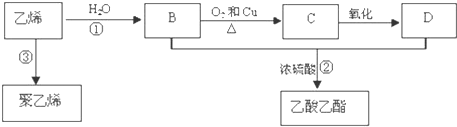
分析 乙烯发生加聚反应得到聚乙烯,乙烯与水发生加成反应生成B为CH3CH2OH,乙醇在Cu作催化剂条件下发生氧化反应生成C为CH3CHO,CH3CHO可进一步氧化得到D为CH3COOH,CH3CH2OH和CH3COOH在浓硫酸作用下发生酯化反应生成CH3COOCH2CH3,以此解答该题.
解答 解:乙烯发生加聚反应得到聚乙烯,乙烯与水发生加成反应生成B为CH3CH2OH,乙醇在Cu作催化剂条件下发生氧化反应生成C为CH3CHO,CH3CHO可进一步氧化得到D为CH3COOH,CH3CH2OH和CH3COOH在浓硫酸作用下发生酯化反应生成CH3COOCH2CH3,
(1)乙烯含有碳碳双键,结构简式为CH2=CH2,故答案为:CH2=CH2;
(2)反应①是乙烯与水发生加成反应生成乙醇,D为CH3COOH,含官能团名称为:羧基,
故答案为:加成反应;羧基;
(3)反应①乙烯和水加成反应生成乙醇,反应的方程式为CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH;
反应②乙醇和乙酸发生酯化反应生成乙酸乙酯,反应的方程式为C2H5OH+CH3COOH 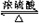 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
反应③乙烯可以发生加聚反应生成聚乙烯,反应为: ,
,
故答案为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH;C2H5OH+CH3COOH 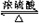 CH3COOC2H5+H2O;
CH3COOC2H5+H2O; ;
;
(4)由反应产物可知,工艺二原子利用率为100%,在实际生产中,应采用工艺二更环保、更经济,故答案为:工艺二.
点评 本题考查有机物推断,涉及烯烃、醇、醛、羧酸性质与转化,难度不大,注意基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 改变反应条件可以改变该反应的限度 | |
| B. | 达到平衡后,SO3、SO2、O2在密闭容器中共存 | |
| C. | 达到平衡后,反应停止,正、逆反应速率都等于零 | |
| D. | 为了提高SO2的转化率,应适当提高O2的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.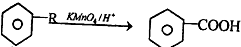
 是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).
是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴离子具有氧化性 | B. | 氯气是还原剂 | ||
| C. | 该反应属于取代反应 | D. | 氯气的氧化性比溴单质强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
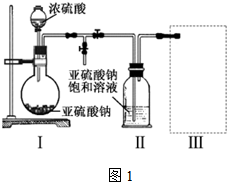
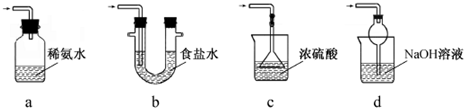

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:2:3 | C. | 3:2:1 | D. | 6:3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com