
| A. | 用氨水鉴别Al3+、Mg2+和Ag+ | |
| B. | 用加热法分离NH4Cl和I2 | |
| C. | 用无水乙醇提取碘水中的单质碘 | |
| D. | 用饱和Na2CO3溶液鉴别乙酸和乙酸乙酯 |
 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | ④⑤③ | B. | ⑥①⑤③ | C. | ⑧①⑦③ | D. | ⑤②⑥③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4℃时,18g 21H2168O中含有电子数为10NA | |
| B. | 在密闭容器中加入1.5 mol H2和0.5 molN2,充分反应后可得到NH3分子数为NA | |
| C. | 常温下,1L0.1mol•L-1的NH4NO3溶液中所含氮原子数为0.2 NA | |
| D. | 标准状况下,22.4 L的CCl4中C-Cl键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂与还原剂的物质的量之比为1:6 | |
| B. | HCl发生还原反应 | |
| C. | 氧化性KClO3>Cl2 | |
| D. | 被还原的物质是HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
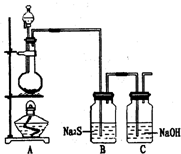 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
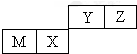
| A. | 离子半径Z<Y<M | |
| B. | X的氧化物能与水反应生成相应的酸 | |
| C. | 气态氢化物的稳定性:Z>Y>X | |
| D. | Y的最高价氧化物对应的水化物属于共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
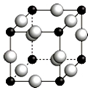 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,2.8gCO与N2混合气体中含有的原子总数为0.2NA | |
| B. | 标准状况下,2.24L乙烷含有分子的数目为0.1NA | |
| C. | 1L1mol•L-1的CuCl2溶液中含有Cu2+的数目为NA | |
| D. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
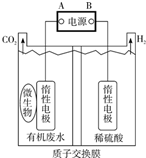 在微生物作用下,电解有机废水(含CH3COOH),实现废水处理的同时,可获得清洁能源H2.其原理如图所示.下列有关说法正确的是( )
在微生物作用下,电解有机废水(含CH3COOH),实现废水处理的同时,可获得清洁能源H2.其原理如图所示.下列有关说法正确的是( )| A. | 电极A为负极 | |
| B. | 电解中生成的CO2与H2物质的量之比为1:1 | |
| C. | 阳极反应为:CH3COOH一8e-+8OH-═2CO2↑+6H2O | |
| D. | 电解前后,阴极室的pH几乎保持不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com