
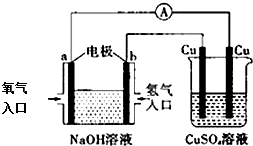
| A. | 该装置中a极为负极 | |
| B. | 该装置中b极的电极反应式是:2H++2e-=H2↑ | |
| C. | 一段时间后,左边装置中溶液pH增大 | |
| D. | CuSO4溶液浓度保持不变 |
分析 左侧为原电池,通入氧气的一极为正极,发生还原反应,电极方程式为O2+2H2O+4e-=4OH-,通入氢气的一极为负极,发生氧化反应,电极方程式为H2+2OH--2e-=2H2O,右侧为电解池,阳极上铜失电子生成铜离子,阴极铜离子得电子生成Cu,以此解答该题.
解答 解:A.该装置中a极通入的是氧气,氧气在正极得电子,所以a为正极,故A错误;
B.碱性条件下,氢气失电子生成水,则b极的电极反应式是:H2+2OH--2e-=2H2O,故B错误;
C.左边装置中的总反应是2H2+O2=2H2O,反应一段时间,溶液中氢氧化钠的浓度减小,所以溶液pH减小,故C错误;
D.右侧为电解池,Cu为阳极,阳极上铜失电子生成铜离子,Cu为阴极,阴极上铜离子得电子生成Cu,所以硫酸铜溶液的浓度不变,故D正确.
故选D.
点评 本题综合考查原电池和电解池知识,侧重于学生的分析能力的考查,难度不大,注意把握电极方程式的书写,为解答该题的关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ①②④⑤ | C. | ①②⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理为:
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理为:| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
| SO2 | O2 | SO2 | O2 | ||
| 1 | T1 | 4 | 2 | x | 0.8 |
| 2 | T2 | 4 | 2 | 0.4 | y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业生产硫酸时,常用NaOH吸收尾气中的少量SO2 | |
| B. | 利用Fe3+作为混凝剂,可以对硬水进行软化 | |
| C. | N2与O2作用生成NO,属于氮的固定 | |
| D. | 石油的分馏、煤的气化或液化都是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚呈弱酸性,能使石蕊试液显浅红色 | |
| B. | 苯酚分子中的13个原子有可能处于同一平面上 | |
| C. | 苯酚可以和硝酸发生加成反应 | |
| D. | 苯酚能与FeCl3溶液反应生成紫色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①②④ | C. | ①② | D. | 只有② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com