
【题目】C60 晶体的晶胞结构如图所示,下列说法正确的是( )
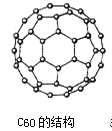
A.该晶体熔化时需克服共价键
B.1个晶胞中含有 8 个 C60 分子
C.晶体中 1 个 C60 分子有 12 个紧邻的C60 分子,属于分子密堆积类型
D.晶体中 C60 分子间以范德华力结合,故 C60 分子的热稳定性较差
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.聚丙烯能使酸性高锰酸钾溶液褪色
B.聚乙烯是由分子组成的化合物,有固定的熔点
C.同质量的乙烯和聚乙烯燃烧后生成的![]() 的质量相等
的质量相等
D.高分子化合物的特点之一是组成元素简单、结构复杂、相对分子质量大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核磁共振氢谱是研究有机物结构的有力手段之一。
(1)分子式均为C3H6O2的两种混合物,在核磁共振氢谱上观察到氢原子的峰有两种情况,第一种情况中峰面积比是1:1,第二种情况中峰面积之比为3:2:1,由此推断该混合物的组成可能是__(写出一种情况即可)。
(2)有一种有机物的分子式为C7H8O,苯环上有1个羟基,请写出该有机物可能的结构简式__,核磁共振氢谱上观察到氢原子的峰面积比为__(对应上一空所填物质)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物材料衍生物2,5-呋喃二甲酸(![]() )可以替代化石燃料衍生物对苯二甲酸,与乙二醇合成材料聚2,5-呋喃二甲酸乙二醇酯(PEF)。下列说法正确的是
)可以替代化石燃料衍生物对苯二甲酸,与乙二醇合成材料聚2,5-呋喃二甲酸乙二醇酯(PEF)。下列说法正确的是
A. 合成PEF的反应为加聚反应
B. PEF不能与氢气发生加成反应
C. 通过红外光谱法测定PEF的平均相对分子质量,可得其聚合度
D. 聚对苯二甲酸乙二醇酯的结构简式为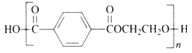
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是基本的有机化工原料。用A和常见的有机物可合成一种醚类香料和一种缩醛类香料(M)。具体合成路线如图所示(部分反应条件略去):
是基本的有机化工原料。用A和常见的有机物可合成一种醚类香料和一种缩醛类香料(M)。具体合成路线如图所示(部分反应条件略去):
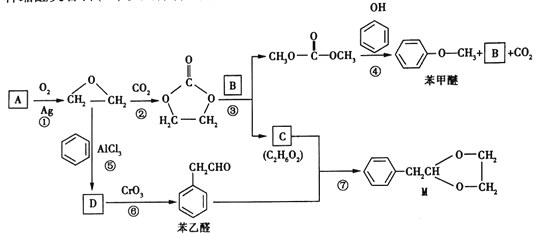
已知:①![]() 。
。
②D为单取代芳香族化合物且能与金属钠反应;每个D分子中只含有1个氧原子,D中氧元素的质量分数约为13.1%。试回答下列问题:
(1)A的名称是_______,图中缩醛(M)的分子式是______。
(2)B的结构简式为___________。
(3)⑤的化学方程式为_____________。
(4)⑥的反应类型是___________。
(5)请写出核磁共振氢谱有4组峰,且峰面积之比为3∶2∶2∶1,并含有苯环和![]() 结构的苯乙醛的所有同分异构体的结构简式:_____________。
结构的苯乙醛的所有同分异构体的结构简式:_____________。
(6)参照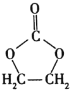 的合成路线,设计一条由
的合成路线,设计一条由![]() 氯丙烷和必要的无机试剂制备
氯丙烷和必要的无机试剂制备 的合成路线(注明必要的反应条件):_________________________。
的合成路线(注明必要的反应条件):_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据环保要求,在处理有氰电镀废水时,剧毒的CN-离子在催化剂TiO2颗粒作用下,先用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用如图装置进行实验,测定CN-被处理的百分率。

现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)根据题意,写出相关主要反应的离子方程式:甲中的反应_________________,乙中的反应:_____________________。
(2)上述实验是通过测定CO2的量来确定对CN-的处理效果。丙装置中的试剂是______________,丁装置的目的是________________________;干燥管Ⅱ的作用是______________________。
(3)假定上述每一个装置都充分吸收,则利用该装置测得的CN-被处理的百分率与实际值相比_____(填“偏高”或“偏低”),简述可能的原因:______________________。
(4)含氰废水也可采用电化学方法进行处理。在碱性条件下,使用惰性电极电解含氰废水,氰离子被氧化为无毒的物质,其中阳极电极反应式是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素原子序数依次增大,前四种为短周期元素,E、F位于第四周期。已知A是自然界中含量最多的元素;B、C、D同周期,且B在同周期元素中第一电离能最小;C的第一、二、三电离能分别为738 kJ·mol1、1451 kJ·mol1、7733 kJ·mol1;D在同周期元素中(除稀有气体元素外)第一电离能最大;E元素为金属元素,常用于合成催化剂,其基态原子的价电子数为7;F元素的某种高价盐可用作城市饮用水的净水剂,比D的单质用于净水更安全环保,F基态原子的3d能级上有6个电子。
(1)试写出下列四种元素的元素符号:A_____;B_____;E_____;F_________。
(2)写出A、B两种元素组成的所有化合物的化学式:_____________。
(3)写出电解CD2的化学方程式:_____。
(4)E、F均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
元素 | E | F | |
电离能/ kJ·mol1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
E元素位于第ⅦB族,请画出基态E2+的价电子排布图:_____,F元素在周期表中的位置是_____。比较两元素的I2、I3可知,气态基态E2+再失去1个电子比气态基态F2+再失去1个电子更难,对此你的解释是:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如下微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是
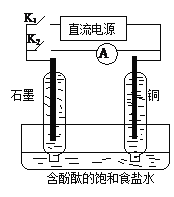
A. 断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl—![]() Cl2↑+H2↑
Cl2↑+H2↑
B. 断开K2,闭合K1时,石墨电极附近溶液变红
C. 断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e—=2Cl—
D. 断开K1,闭合K2时,石墨电极作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列化合物:①NaOH,②H2SO4,③CH3COOH,④NaCl,⑤CH3COONa,⑥NH4Cl,⑦CH3COONH4,⑧NH4H2SO4,⑨NH3·H2O,请回答下列问题:
(1)若浓度均为0.1mol·L-1、等体积的NaOH和NH3·H2O分别加水稀释m倍、n倍,
稀释后两种溶液的pH都变成9,则m_______n (填“>”、“<”或“=”)。
(2)已知水存在如下平衡:H2O+H2O![]() H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是_______。
H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是_______。
A.向水中加入NaHSO4固体 B.向水中加NaHCO3固体
C.加热至100℃ [其中c (H+) =1×10-6 mol·L-1] D.向水中加入NH4Cl固体
(3)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=_______;在pH=3的CH3COOH溶液中,水电离出来的c(H+)=_______。
(4)NH4Cl溶液中离子浓度大小顺序为______________。
(5)物质的量浓度相同的⑥、⑦、⑧、⑨四种稀溶液中,NH4+浓度由大到小的顺序是(填序号)_______。
(6)己知t℃时,Kw=1×10-12,在该温度时将pH=9的NaOH溶液a L与pH=2的H2SO4溶液bL混和(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则出a∶b=_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com