
| A. | NaOH溶液 | B. | Na2CO3溶液 | ||
| C. | 石蕊试液 | D. | 新制的Cu(OH)2悬浊液 |
分析 乙酸与氢氧化铜反应生成蓝色溶液、葡萄糖与氢氧化铜反应生成砖红色沉淀,乙醇与氢氧化铜不反应,以此来解答.
解答 解:A.乙酸与NaOH反应不明显,葡萄糖溶液、乙醇均与NaOH不反应,不能鉴别,故A不选;
B.葡萄糖溶液、乙醇均与碳酸钠溶液不反应,不能鉴别,故B不选;
C.葡萄糖溶液、乙醇与石蕊混合现象相同,不能鉴别,故C不选;
D.乙酸与氢氧化铜反应生成蓝色溶液、葡萄糖与氢氧化铜反应生成砖红色沉淀,乙醇与氢氧化铜不反应,现象不同,可鉴别,故D选;
故选D.
点评 本题考查物质的鉴别,为高频考点,把握物质的性质、发生的反应与现象为解答的关键,侧重分析与实验能力的考查,注意有机物性质与实验的结合,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用大理石和稀盐酸制取CO2:CO32-+2H+═CO2↑+H2O | |
| B. | Al(OH)3加入NaOH溶液:Al(OH)3+OH-═AlO2-+2H2O | |
| C. | 向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | 向偏铝酸钠溶液通入过量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10.0 g CaCO3与足量稀盐酸反应,消耗H+的数目为0.2 NA | |
| B. | 0.1 mol Ar所含的原子数为0.1NA | |
| C. | 200 mL 0.1 mol/L的Na2SO4中含Na+数目为0.04NA | |
| D. | 25℃、101 kPa时,Zn与稀硫酸反应生成2.24 L H2,转移的电子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸水性 | B. | 脱水性 | C. | 强氧化性 | D. | 酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
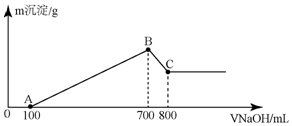 将某质量的镁铝合金溶解在500mL盐酸中,向反应后的溶液中逐滴加入2mol/LNaOH溶液,产生沉淀质量与碱溶液体积的关系如图所示,请填写下列空白:
将某质量的镁铝合金溶解在500mL盐酸中,向反应后的溶液中逐滴加入2mol/LNaOH溶液,产生沉淀质量与碱溶液体积的关系如图所示,请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com