
【题目】实验是化学研究的基础。下列有关实验装置进行的相应实验,不能达到实验目的的是

图1 图2 图3 图4
A. 用图1所示装置吸收多余的Cl2
B. 用图2所示装置蒸发NaCl饱和溶液制备NaCl晶体
C. 用图3所示装置制取少量纯净的CO2
D. 用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
科目:高中化学 来源: 题型:
【题目】海水晒盐的原理是( )
A.海水分解
B.温度升高,其他溶质的溶解度增大
C.升高温度,降低食盐在水中的溶解度
D.利用阳光、风力蒸发水分使氯化钠成晶体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石化产品乙烯、丙烯为原料合成厌氧胶的流程如图. 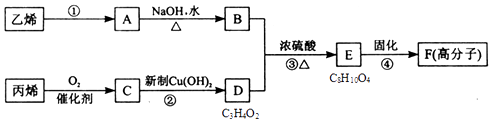
关于该过程的相关叙述正确的是( )
A.反应④的反应类型是加聚
B.物质A含有两种官能团
C.物质B催化氧化后可以得到乙醛
D.1mol物质D最多可以消耗2molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节.回答下列问题: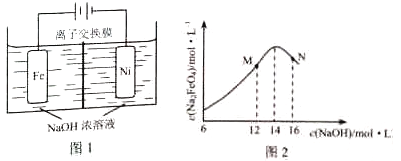
(1)与汽油相比,氢气作为燃料的优点是(至少答出两点).但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式: .
(2)氢气可用于制备H2O2 . 已知:
H2(g)+A(l)═B(l)△H1
O2(g)+B(l)═A(l)+H2O2(l)△H2
其中A、B为有机物,两反应均为自发反应,则H2(g)+O2(g)═H2O2(l)的△H=0(填“>”或“=”)
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)MHx+2y(s)△H<0达到化学平衡.下列有关叙述正确的是
a.容器内气体压强保持不变
b.吸收ymol H2只需1molMHx
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为 .
(5)化工生产的副产氢也是氢气的来源,电解法制取有广泛用途的Na2FeO4 . 同时获得氢气:Fe+2H2O+2OH﹣→FeO42﹣+3H2↑,装置如图所示,装置通电后,铁电极附近生成紫红色FeO42﹣ , 镍电极有气泡产生.若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质.
已知:Na2FeO4只在强碱性条件下稳定,易被H2还原.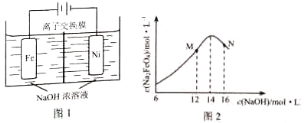
①电解一段时间后,c(OH﹣)降低的区域在(填“阴极室”或“阳极室”).
②电解过程中,须将阴极产生的气体及时排出,其原因为 .
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟、氯、溴、碘四种元素,下列有关它们的性质递变规律的说法,不正确的是( )
A. 单质的密度依次增大
B. 单质的熔点和沸点依次升高
C. 氯气可从碘化钾溶液中置换出碘
D. 溴单质可从氯化钠溶液中置换出氯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴体的装置示意图及有关数据如表:
苯 | 溴 | 溴苯 | |
密度/gcm﹣3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.再将b中的液溴慢慢加入a中,充分反应.装置a中主要反应:;装置d的作用 .
(2)反应过程中,a外壁温度升高.为提高原料的利用率,可采取以下措施:
①采用装置c进行冷凝回流,回流的主要物质有 .
②利用温度计控制温度,适宜的温度范围为(填序号).
A.>156℃B.59℃﹣80℃C.<59℃
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL 10%的NaOH溶液、10mL水洗涤.
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.
步骤②中NaOH溶液洗涤的主要作用是(用化学方程式表示);
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为 , 要进一步提纯,下列操作中必须的是(填序号).
A.分液 B.过滤 C.蒸馏 D.萃取
(5)在该实验中,a的容积最适合的是(填序号).
A.25mL
B.50mL
C.250mL
D.500mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一硫酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀,滤液与4molL﹣1NaOH溶液时恰好完全中和.试求:
(1)混合液H2SO4、HNO3的物质的量浓度各是多少?
(2)另取10mL原混合液稀释至80mL,加入1.92g铜粉共热时,收集到气体在标准状况下的体积为多少毫升?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应aA(g)+bB(g)pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应是热反应,且a+bp(填“>”“<”或“=”).
(2)减压时,A的质量分数(填“增大”“减小”或“不变”,下同),正反应速率 .
(3)若加入B(体积不变),则A的转化率 , B的转化率 .
(4)若升高温度,则平衡时,B、C的浓度之比 ![]() 将
将
(5)若加入催化剂,平衡时气体混合物的总物质的量 .
(6)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色 , 而维持容器内气体的压强不变,充入氖气时,混合物的颜色 . (填“变浅”“变深”或“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com