
分析 钢铁的腐蚀分为化学腐蚀和电化学腐蚀,由于平时使用的钢铁绝大多数为合金,据此分析所发生的腐蚀类型;钢铁的电化学腐蚀中,铁做负极;钢铁的电化学腐蚀中,以吸氧腐蚀为主,氧气在正极上放电.
解答 解:钢铁的腐蚀分为化学腐蚀和电化学腐蚀,由于平时使用的钢铁绝大多数为合金,故以电化学腐蚀为主;钢铁的电化学腐蚀中,铁做负极,电极反应为:Fe-2e-=Fe2+;钢铁的电化学腐蚀中,以吸氧腐蚀为主,氧气在正极上放电,电极反应为:2H2O+O2+4e-=4OH-.故答案为:电化学;Fe-2e-=Fe2+;2H2O+O2+4e-=4OH-.
点评 本题考查了钢铁的腐蚀,应注意是钢铁的腐蚀以电化学腐蚀为主,电化学腐蚀以吸氧腐蚀为主.


科目:高中化学 来源: 题型:解答题
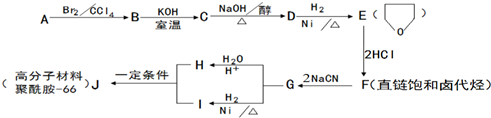
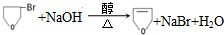 .
.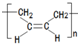 .
. .
.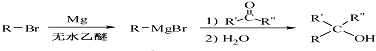
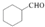 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: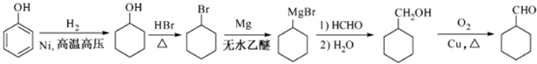 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
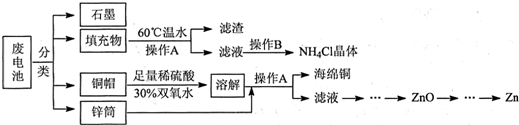
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(D)=0.40 mol•L-1•s-1 | B. | V (C)=0.50 mol•L-1•s-1 | ||
| C. | V(B)=1.2 mol•L-1•min-1 | D. | V(A)=0.30 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ④⑤ | C. | ③④⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
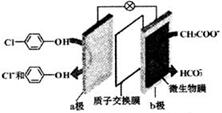 利用微生物电池处理含乙酸钠和对氯酚(
利用微生物电池处理含乙酸钠和对氯酚(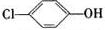 )的废水,工作原理如图所示.下列说法正确的是( )
)的废水,工作原理如图所示.下列说法正确的是( )| A. | 电极b是正极 | B. | 质子从a极移向b极 | ||
| C. | 处理后的废水pH升高 | D. | a极的电极反应式: |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ | |
| C. | 反应至4min时,若HCl的浓度为0.12mol•L-1,则H2的反应速率为:0.015mol/(L•min) | |
| D. | 当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol•L-1的NaOH溶液恰好反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com