
| A. |  盐桥中的K+移向ZnSO4溶液 | |
| B. | 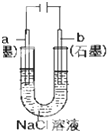 工作一段时间后,a极附近溶液的C(OH-)增大 | |
| C. | 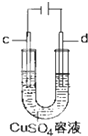 工作时,c极为发生氧化反应 | |
| D. |  电子由Zn流向Fe,装置中有Fe2+生成 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 氨的合成是目前普遍使用的人工固氮方法.
氨的合成是目前普遍使用的人工固氮方法.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、CO32- | |
| B. | 无色溶液中:Mg2+、MnO4-、SO42-、K+ | |
| C. | 滴加紫色石蕊溶液显红色的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | 与铝反应产生大量氢气的溶液:Na+、K+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与NaOH反应的氯气一定为0.5 mol | |
| B. | 反应后的溶液中n(Na+)﹕n(Cl-)可能为9﹕5 | |
| C. | 若反应中转移的电子为n mol,则0.20<n<0.30 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11﹕2﹕1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SiH4比CH4稳定 | |
| B. | O2- 半径比F- 的小 | |
| C. | Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强 | |
| D. | P和S属于第三周期的元素,H3PO4酸性比H2SO4的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 427 | 700 | 800 |
| 平衡常数 | 9.94 | 9 | b | 0.64 |
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3[m] |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe、Cu元素在白然界中主要以化合态形式存在 | |
| B. | CO在高温下能将Fe203还原为Fe | |
| C. | Fe与盐酸、Fe与Cl2发生反应均生成FeCl3 | |
| D. | 制作印刷电路板时,可用FeCl3溶液腐蚀Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com