
常温下, 浓度均为0. 1 mol/L的6种溶液的pH如下表:
|
序号 |
a |
b |
c |
d |
e |
f |
|
溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
NaAlO2 |
|
pH |
8. 8 |
9. 7 |
11. 6 |
10. 3 |
11. 1 |
11. 3 |
(1)上述溶液中的阴离子结合H+能力最弱的为 。(填阴离子化学式)
(2)NaAlO2溶液呈碱性的原因是 (用离子方程式表示)。将溶液加热蒸干最后得到的固体产物是 ;
(3)结合表中数据分析, 与0. 1 mol/L的CH3COONa溶液中水的电离程度相同的有 (填字母代号)。
A.pH=8. 8的NaOH溶液 B. pH=5. 2的NH4Cl溶液 C.pH=5. 2的盐酸
D. 0. 1 mol/L的NaCN溶液 E.pH=8. 8的Na2CO3溶液
(4)将浓度均为0. 1 mol/L的b、c等体积混合, 所得溶液中各离子浓度关系正确的有 。
A.c(Na+)= c(CO32-) +c(HCO3-) +c(H2CO3)
B. 2c(Na+)=3c(CO32-) +3c(HCO3-) +3c(H2CO3)
C. c(OH-)= c(H+) +c(HCO3-) +2c(H2CO3)
D. c(Na+) +c(H+) = 2c(CO32-) +c(HCO3-) +c(OH-)
E. c(Na+)>c(HCO3-)> c(CO32-) > c(OH-)> c(H+)
F. c(Na+)> c(CO32-) > c(HCO3-) > c(H+)> c(OH-)
(5)0.2 mol/LHCl与0.1 mol/L NaAlO2溶液等体积混合溶液后离子浓度顺序为 。
(1)CH3COO-
(2)AlO- +2H2O
 Al(OH)3+OH- ,
NaAlO2
Al(OH)3+OH- ,
NaAlO2
(3) BE (4)BDE (5)c(Cl- )>c(Na+)>c(Al3+)>c(H+)>c(OH- )
【解析】
试题分析:
(1)相同浓度的钠盐溶液,pH越小则盐的水解程度越小,阴离子结合H+能力最弱的就是弱酸根对应的酸酸性最强的。酸性强弱CH3COOH>H2CO3>HClO>HCN>HAlO2,所以阴离子结合H+能力最弱的为CH3COO-。
(2)NaAlO2是强碱弱酸盐,AlO-水解使溶液显碱性,AlO- +2H2O Al(OH)3+OH- , NaAlO2水解生成NaOH和Al(OH)3,二者均不易分解和挥发,所以将溶液加热蒸干最后得到的固体产物是NaAlO2 。
Al(OH)3+OH- , NaAlO2水解生成NaOH和Al(OH)3,二者均不易分解和挥发,所以将溶液加热蒸干最后得到的固体产物是NaAlO2 。
(3)0.1mol/L的CH3OONa溶液,促进水的电离,水电离的c(OH-)=10−14 /10−8.8 =10-5.2mol/L
A.pH=8.8的NaOH溶液,抑制水的电离,水电离的c(H+)=10-8.8mol/L;
B.pH=5.2的NH4Cl溶液,促进水的电离,水电离的c(H+)=10-5.2mol/L;
C.pH=5.2的盐酸,抑制水的电离,水电离的c(OH-)=10−14 /10−5.2 =10-8.8mol/L;
D.0.1mol/L的NaCN溶液,促进水的电离,水电离的c(H+)=10-11.1mol/L;
E.pH=8.8的Na2CO3溶液,促进水的电离,水电离的c(OH-)=10−14 /10−8.8 =10-5.2mol/L;
所以与0.1mol/L的CH3OONa溶液中水的电离程度相同的是:BE;故答案为:BE;
(4)将浓度均为0. 1 mol/L的NaHCO3、Na2CO3等体积混合,混合溶液中粒子之间符合电荷守恒,物料守恒和质子守恒。NaHCO3溶液有物料守恒:c(Na+)=c(CO32-) +c(HCO3-) +c(H2CO3);Na2CO3溶液有c(Na+)=2c(CO32-) +2c(HCO3-) +2c(H2CO3;二式相加即2c(Na+)=3c(CO32-) +3c(HCO3-) +3c(H2CO3;B正确。电荷守恒c(Na+) +c(H+) = 2c(CO32-) +c(HCO3-) +c(OH-)D正确; CO32- 水解程度大于HCO3-,溶液呈碱性,所以有c(Na+)>c(HCO3-)> c(CO32-) > c(OH-)> c(H+) ,E正确。
考点:本题考查盐类水解素、化学平衡的影响因素、


科目:高中化学 来源: 题型:
(10分)复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是___________(填编号)。
A.CO2+H2O+2NaClO=Na2CO3+2HClO
B.CO2+H2O+NaClO=NaHCO3+HClO
C.CO2+H2O +C6H5ONaNaHCO3+C6H5OH
D.CO2+H2O +2C6H5ONaNa2CO3+2C6H5OH
E.Na2CO3+C6H5OHNaHCO3+C6H5ONa
F.CH3COOH+NaCN=CH3COONa+HCN
(2)根据前述信息判断,常温下浓度均为0.05mol/L的下列5种物质的溶液中,pH最小的是_____(填编号),其pH值为_______(填数值);pH最大的是____(填编号)。
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
③蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体
请根据上述反应,总结出复分解反应发生的另一规律: ;
(4)根据(3)中结论,现将KI溶液和AgCl固体混合搅拌,则可能会观察到的现象是 ,反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2012届湖南省湖南师大附中高三第三次月考化学试卷 题型:填空题
(12分)复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH:
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O。若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较强的物质。依照该规律,请判断下列反应不能成立的是 (填字母序号)。
A.CO2+H2O+2NaClO===Na2CO3+2HClO
B.CO2+H2O+NaClO===NaHCO3+HClO
C.CH3COOH+NaOH===CH3COONa+HCN
(2)根据上述信息判断,常温下浓度均为0.05mol/L的下列5种物质的溶液中,pH最小的是 (填序号),其pH为 (填数值);pH最大的是 (填序号)。
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
(3)已知溶液积常数:KSP(AgI)=9.3×10-17,KSP(AgCl)=1.8×10-10,现将KI溶液和AgCl固体混合搅拌,则可能会观察到的现象是 ,其离子反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2010年四川省南山中学高三上学期入学考试(理综)化学部分 题型:填空题
(14分)
I.常温下浓度均为0.l mol/L的下列溶液:①Na2CO3溶液②NaHCO3溶液③盐酸④氨水
回答下列问题。
(1)上述溶液中有水解反应发生的是 (填编号,下同),溶液中溶质存在电离平衡的是 。
(2)四种溶液中对水的电离抑制作用最大的是 ;比较①、②溶液,pH较大的是 。
(3)在溶液④中加入NH4Cl固体,NH+4浓度与OH-浓度的比值将____(填“变大”、“变小”、“不变”)
II.有一瓶无色澄清溶渡,其中可能含有:NH+4、K+、Mg2+、Al3+、Fe2+、NO-3、Cl-、SO2-4、CO2-3取该溶液进行下列实验:
(1)取部分溶液,向其中逐滴滇入Ba(OH
 )2溶液至过量,有白色沉淀生成,沉淀量与加入Ba(OH)2溶液量的关系如右图所示。
)2溶液至过量,有白色沉淀生成,沉淀量与加入Ba(OH)2溶液量的关系如右图所示。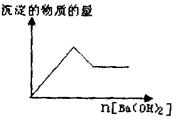
(2)取(I)反应后过滤所得沉淀和滤液,在沉淀中加入稀盐酸后,沉淀不减少。将滤液分为两等份,一份加热,未产生刺激性气味的气体;另一份如HNO3酸化时有白色沉淀产生,继续加HNO3,沉淀又消失,再加AgNO3没有变化。
根据以上事实确定:该溶液中肯定 存在的离子有 ;
存在的离子有 ;
肯定不存在的离子有____ 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省龙岩市高三上学期期末考试化学试卷(解析版) 题型:填空题
X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表是常温下浓度均为0.0 1 mol·L-1的X、Y、Z、W溶液的pH。
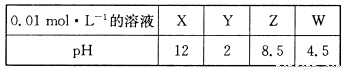
(1)X、W的化学式分别为_______、________。
(2)W的电离方程式为______________________________。
(3)25℃时,Z溶液的pH>7的原因是______________________________________(用离子方程式表示)。
(4)将X、Y、Z各1mol·L-1同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为 _______________________________________________________ 。
(5)Z溶液与W溶液混合加热,可产生一种无色无味的单质气体,该反应的化学方程式为__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2010年河南省高三上学期9月月考化学试题 题型:填空题
(10分)复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
 复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是___________(填编号)。
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是___________(填编号)。
A.CO2+H2O +2NaClO=Na2CO3+2HClO
B.CO2+H2O +NaClO=NaHCO3+HClO
C.CO2
+H2O +C6H5ONa NaHCO3+C6H5OH
NaHCO3+C6H5OH
D.CO2
+H2O +2C6H5ONa Na2CO3+2C6H5OH
Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH NaHCO3+C6H5ONa
NaHCO3+C6H5ONa
F.CH3COOH+NaCN=CH3COONa+HCN
(2)根据前述信息判断,常温下浓度均为0.05 mol/L的下列5种物质的溶液中,pH最小的是_____(填编号),其pH值为_______(填数值);pH最大的是____(填编号)。
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
③蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体
请根据上述反应,总结出复分解反应发生的另一规律: ;
(4)根据(3)中结论,现将KI溶液和AgCl固体混合搅拌,则可能会观察到的现象是 ,反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com