
【题目】下列物质属于电解质的是( )
A.铜
B.氯化钠
C.稀硫酸
D.酒精
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一种价电子排布为2s22p5的元素,下列有关它的描述正确的有
A. 原子序数为8
B. 在同周期元素中非金属性最强
C. 在同周期元素中,其原子半径最大
D. 在同周期元素中,元素的第一电离能最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L容积不变的容器中,发生N2+3H2 NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol·L-1·s-1,则10 s后容器中N2的物质的量是( )
A. 1.6 mol B. 2.8 mol C. 3.6 mol D. 3.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)有下列六组物质:属于同系物的是______,属于同分异构体是______,属于同种物质的是______(填序号)。
A.![]() 与
与![]() B.
B.![]() 与
与![]() C.
C.![]() 与
与![]()
D.![]() 与
与![]() E.ClC(CH3)3与(CH3)2CHCH2Cl F.
E.ClC(CH3)3与(CH3)2CHCH2Cl F.![]() 与CH3﹣CH2Cl
与CH3﹣CH2Cl
(2)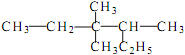 的系统命名_________________。
的系统命名_________________。
(3)![]() 的系统命名__________________________。
的系统命名__________________________。
(4)右图有机物的分子式_________________![]() 。
。
(5)甲基的电子式_________________。
(6)某烃的分子量为72,跟氯气反应生成的一氯代物只有一种,该烃的结构简式为_________________。
(7)C7H8O属于芳香族化合物且能发生催化氧化反应,该反应方程式为:_________________。
(8)某有机物X分子中只含C、H、O三种元素,相对分子质量小于110,其中氧元素的质量分数为14.8%,已知该物质可与FeCl3溶液发生显色反应,则X的分子式为__________。若1 mol X与浓溴水反应时消耗了3 mol Br2,则X的结构简式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 最外层都只有2个电子的X、Y原子,化学性质一定相似
B. 在所有的元素中,氟的电负性最大
C. 前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有4种
D. 次氯酸分子的电子式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.非金属元素的原子间不能形成离子化合物
B.Cl2、Br2、I2的分子间作用力依次增强,熔沸点依次升高
C.氯化氢气体溶于水共价键被破坏
D.100℃时水由液态变为气态,分子间作用力被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明:H2O2具有立体结构,两个氢原子像在一本半展开的书的两页纸上,两页纸面的夹角为94°,氧原子在书的夹缝上,O—H键与O—O键之间的夹角为97°。下列说法不正确的是( )
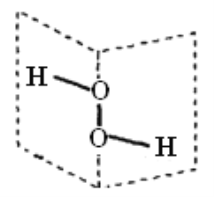
A. H2O2分子中既含极性键,又含非极性键
B. H2O2为极性分子
C. H2O2分子中的两个O原子均是sp3杂化
D. H2O2分子中既有σ键,又有π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金在生活、生产、国防等领域有广泛应用。镍是重要的合金元素,例如镧镍合金、白铜(铜镍合金)、铝镍合金等。
(1)基态镍原子的外围电子排布式为_____________。
(2)在NiSO4溶液中滴加稀氨水能形成配位化合物[Ni(NH3)4]SO4。
①H、N、O、Ni的电负性大小顺序为______________________。
②与SO42—互为等电子体的分子(写出一种即可)______________。
③SO32—、SO42—中S的杂化类型都是___________;但它们的实际空间构型却不同,其主要原因是________________________________________________________________。
(3)工业上,采用反应Ni(s)+4CO(g)![]() Ni(CO)4(g)提纯粗镍。推测Ni(CO)4晶体中存在的作用力有__________。
Ni(CO)4(g)提纯粗镍。推测Ni(CO)4晶体中存在的作用力有__________。
a、范德华力 b、配位键 c、非极性键 d、极性键 e、离子键
(4)镧镍合金的晶胞如图1所示,镍原子除了1个在体心外,其余都在面上。该合金中镍原子和镧原子的个数比为________。
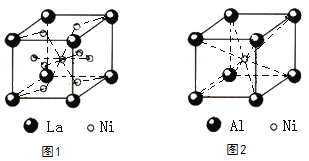
(5)铝镍合金的晶胞如图2所示。已知:铝镍合金的密度为ρg/cm3,NA代表阿伏加德罗常数的数值,则镍、铝的最短核间距(d)为________________pm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com