
| A.铜 | B.钠 | C.铍 | D.铝 |
科目:高中化学 来源:不详 题型:填空题

| | 开始 | 完全 |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.3 | 5.0 |
| Mn2+ | 8.3 | 9.8 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
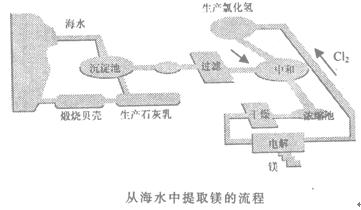
 ①将海边大量的贝壳煅烧成生石灰,并将生石灰制成石灰乳;
①将海边大量的贝壳煅烧成生石灰,并将生石灰制成石灰乳;
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 的铁圈上,下面放置盛沙的蒸发皿。将适量的炒干的氧化铁粉末和铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条,引燃氧化铁和铝粉的混合物,反应剧烈进行,发出耀眼的强光,生成铁和氧化铝。
的铁圈上,下面放置盛沙的蒸发皿。将适量的炒干的氧化铁粉末和铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条,引燃氧化铁和铝粉的混合物,反应剧烈进行,发出耀眼的强光,生成铁和氧化铝。| 物质 | Al[] | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
 取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4摩/升的氢氧化钠溶液,所加氢氧化钠溶液的体积(毫升)与产生的沉淀的物质的量(摩尔)的关系如下图所示。
取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4摩/升的氢氧化钠溶液,所加氢氧化钠溶液的体积(毫升)与产生的沉淀的物质的量(摩尔)的关系如下图所示。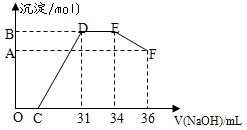
 述现象说明溶液中 、
述现象说明溶液中 、 、 结合OH-的能力比 强(填离子符号)。
、 结合OH-的能力比 强(填离子符号)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.3mol/L的HCl | B.4mol/L的HNO3 |
| C.8mol/L的NaOH | D.18mol/L的H2SO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.甲、乙中都是铝过量 | B.甲中铝过量,乙中碱过量 |
| C.甲中酸过量,乙中铝过量 | D.甲中酸过量,乙中碱过量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.物质的量之比为1:1 | B.物质的量之比为2:1 |
| C.质量之比为1:1 | D.质量之比为2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com