
甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇:
CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ CO(g)+2H2(g)
CO(g)+3H2(g)……Ⅰ CO(g)+2H2(g) CH3OH(g) ……Ⅱ。
CH3OH(g) ……Ⅱ。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100L反应室,在一定条件下发生反应I,CH4的平衡转化率与温度、压强的关系如图。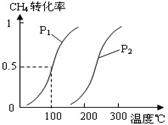
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数的值为 。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下,自发反应Ⅱ,生成甲醇。
③该反应的△H 0;若容器容积不变,下列措施可增加甲醇产率的是 。
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 | D.再充入1mol CO和3mol H2 |
| 实验编号 | T(℃) | n(CO)/n(H2) | P(Mpa) |
| i | 150 | 1/3 | 0.1 |
| ii | | | 5 |
| iii | 350 | | 5 |
(共16分)
(1)(7分)①0.003mol/(L·min)(2分) ②<(2分) 2.25×10-4(3分)
(2)(9分)③<(2分) BD(2分)
④a.(见下表,3分) 实验编号 T(℃) n(CO)/n(H2) P(Mpa) i ii 150 1/3 iii 1/3
b.(见下图,2分)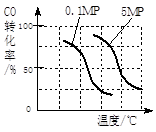
解析试题分析:(1)①起始时c(CH4)=1.0mol/100L=0.01mol/L,读图可知平衡时CH4转化率为0.5,则CH4的变化浓度为0.01mol/L×0.5=0.005mol/L,根据化学反应速率计算公式可知,v(CH4)= 0.005mol/L÷5min=0.001mol/(L?min),根据系数之比等于速率之比可知,v(H2)="3" v(CH4)= 0.003mol/(L?min);②I是气态物质体积增大的反应,因此增大压强平衡左移,CH4转化率减小,减小压强平衡右移,CH4转化率增大,即压强越小,CH4转化率越大,读图可知,200℃、P1时CH4转化率大于200℃、P2时CH4转化率,说明P1< P2;在P1、100℃时,
CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
起始浓度/ mol·L-1 0.01 0.02 0 0
变化浓度/ mol·L-1 0.005 0.005 0.005 0.015
平衡浓度/ mol·L-1 0.005 0.015 0.005 0.015
K="[" c(CO)?c3(H2)]/[ c(CH4)?c(H2O)]= [0.005×0.0153]/[ 0.005×0.015]=2.25×10ˉ4
(2)③II是气态物质体积减小的反应,不符合熵增原理,则正反应符合焓判据,△H<0;正反应是放热反应,升高温度平衡左移,甲醇产率减小,故A错误;减小生成物浓度,平衡右移,甲醇产率增大,故B正确;充入惰性气体,虽然增大压强,但是容器容积不变,各组分浓度不变,平衡不移动,甲醇产率不变,故C错误;再充入投料比相同的CO和H2,就是增大压强,使平衡右移,甲醇产率增大,故D正确;④a、根据控制变量探究的原则,实验i和ii的压强不同,则温度和投料比一定相同;实验ii和iii的温度不同,则投料比和压强一定相同;由此确定实验ii的温度为150℃,投料比为1/3,实验iii的投料比为1/3;b、画图要点:相同温度下,增大压强平衡右移,CO转化率增大,则0.1MPa时CO转化率随温度变化曲线向右适当平移,就变为5MPa时CO转化率随温度变化曲线。
考点:考查化学反应原理,涉及化学反应速率的计算、压强对化学平衡的影响、化学平衡常数的计算、反应热的正负、提高产率的措施、探究实验方案的设计、画图等常见考查方式。


科目:高中化学 来源: 题型:问答题
(15分)请回答下列问题:
(1)分别用浓、稀硝酸溶解等量的两份铜粉,消耗硝酸的物质的量较少的是_________硝酸(填“浓”或“稀”),相应的离子方程式是_____________.
(2) 800 时,在2L的恒容密闭容器中充入2molNO和1molO2发生反应,2NO(g)+O2(g)
时,在2L的恒容密闭容器中充入2molNO和1molO2发生反应,2NO(g)+O2(g) 2NO2(g),经5min达到平衡,测得c(NO)="0.5" mol/L,并放热QkJ。5min内 v(O2)=___________。
2NO2(g),经5min达到平衡,测得c(NO)="0.5" mol/L,并放热QkJ。5min内 v(O2)=___________。
②该条件下,2NO(g)+O2(g) 2NO2(g)的△H= 。
2NO2(g)的△H= 。
③若向平衡混合物中再充入NO、NO2各1mol,此时v正 v逆(填“>”、“=”或“<”)。
④若向平衡混合物中仅充入lmolNO2,平衡向_______(填“正向”、“逆向”或“不”)移
动。达新平衡时,NO2的体积分数________(填“增大”、“减小”或“不变”)。
(3)染料工业排放的废水中含有大量有毒的NO2-,可以在强碱性条件下加入铝粉除去(反应过程中无气态产物生成。加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出)。请写出该反应的离子方程式________
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(14分)为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应:N2 + O2 2NO,是导致汽车尾气中含有NO的原因之一。
2NO,是导致汽车尾气中含有NO的原因之一。
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g) + O2(g) 2NO(g)的△H________0(填“>”或“<”)。
2NO(g)的△H________0(填“>”或“<”)。
②在T3温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率υ(N2)=___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。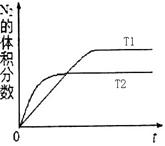
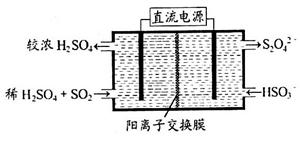
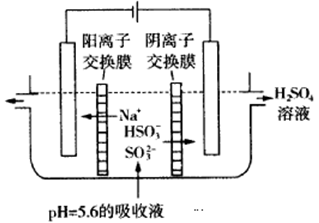
(2)利用右图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为________。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol/L的醋酸与b mol/L
Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
(4)引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等,任写一种与SO42-互为等电子体的分子 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
硫元素的化合物在生产、生活中有着广泛的应用。
(1)400℃,1.01×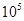 Pa下,容积为1.0L的密闭容器中充入0.5molSO2, (g)和0.3 molO2 (g),发生反应2SO2(g)+O2(g)
Pa下,容积为1.0L的密闭容器中充入0.5molSO2, (g)和0.3 molO2 (g),发生反应2SO2(g)+O2(g) 2SO3(g) △H=-198kJ/mol。反应中n(SO3)和n(O2)随时间变化的关系如右图所示
2SO3(g) △H=-198kJ/mol。反应中n(SO3)和n(O2)随时间变化的关系如右图所示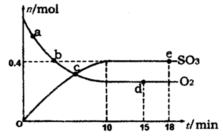 。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。
。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。
| A.a点时刻的正反应速率比b点时刻的大 |
| B.c点时刻反应达到平衡状态 |
| C.d点和e点时刻的c(O2)相同 |
| D.若5 00℃,1.01×105Pa下,反应达到平衡时,n( SO3) 比图中e点时刻的值大 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
已知反应:CO(g)+H2O(g) H2(g)+CO2(g)
H2(g)+CO2(g)
在427°C时的平衡常数是9.4.如果反应开始时,一氧化碳和水蒸气的浓度都是0.01mol·L-1,计算一氧化碳在此反应条件下的转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
碳及其化合物有广泛的用途。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+ H2O(g)  CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是 。(填序号)
CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是 。(填序号)
| A.升高温度 | B.增加碳的用量 | C.加入催化剂 | D.用CO吸收剂除去CO |
 2CO(g) △H=+172.5kJ?mol-1
2CO(g) △H=+172.5kJ?mol-1 CO2(g)+H2(g)的焓变△H=
CO2(g)+H2(g)的焓变△H=  CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为: 。
CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为: 。 CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:| 温度/℃ | 起始量/mol | 平衡量/mol[学科 | 达到平衡所x需时间/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
 2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。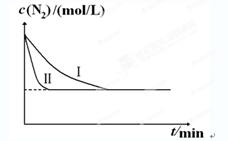

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
在一密闭容器中发生反应: 2A(g)+B(g) E(g)
E(g)
(1)写出该反应的平衡常数表达式___________ ____,已知升高温度时,v(正)>v(逆),此时K值__ __(填“变大”“变小”或“不变”);该反应的△H_____0(填“>”、“=”、“<”);
(2)将1.0mol A和1.0mol B混合后装入2L容器中发生反应,E的物质的量的变化如图所示。
①3分钟内E的平均反应速率为________ _________;
②求此温度下该反应的平衡常数K= (结果保留小数后1位);
③请在图中画出5分钟内A的物质的量变化的曲线;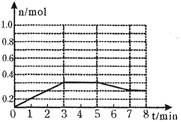
(3)已知在如图所示的变化中,平衡常数K保持不变,则在5~7min内引起E的物质的量变化的原因可能是____________(填编号)。
①降低了温度 ②升高了温度 ③使用了催化剂 ④增大了容器的体积 ⑤缩小了容器的体积 ⑥减少了A的物质的量。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:
CH3COOH+C2H5OH CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有:__________、__________等。
(2)若用如图所示的装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为________、________等。
(3)此反应以浓硫酸为催化剂,可能会造成__________、__________等问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)。
| 同一反应时间 | | 同一反应温度 | ||||
| 反应温度/℃ | 转化率(%) | 选择性(%)* | | 反应时间/h | 转化率(%) | 选择性(%)* |
| 40 | 77.8 | 100 | | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | | 6 | 93.0 | 100 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 30 | 120 | 280 | 350 | 370 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com