
| A. | c(H+)=c(CH3COO-) | |
| B. | 醋酸的物质的量浓度为0.01mol•L-1 | |
| C. | 与pH=12的NaOH溶液等体积混合后,溶液呈碱性 | |
| D. | 加入醋酸钠固体可抑制醋酸的电离,但电离常数Ka不变 |
分析 A、根据电荷守恒来分析;
B、醋酸是弱电解质;
C、由于醋酸是弱电解质,在溶液中只能部分电离;
D、加入醋酸钠固体后,溶液中的醋酸根的浓度增大.
解答 解:A、根据电荷守恒可知,c(H+)=c(CH3COO-)+c(OH-),故A错误;
B、醋酸是弱电解质,不能完全电离,故pH=2的醋酸溶液中氢离子的浓度为0.01mol/L,而醋酸的浓度大于0.01mol/L,故B错误;
C、由于醋酸是弱电解质,在溶液中只能部分电离,故pH=2的醋酸溶液的浓度大于0.01mol/L,故和pH=12的氢氧化钠溶液等体积混合后,醋酸过量,故溶液显酸性,故C错误;
D、加入醋酸钠固体后,溶液中的醋酸根的浓度增大,故醋酸的电离被抑制,但电离平衡常数不变,故D正确.
故选D.
点评 本题考查了弱电解质的电离平衡的移动和酸碱混合后溶液的pH的计算,难度不大,应注意电荷守恒的应用.


科目:高中化学 来源: 题型:选择题
| A. | 加入酚酞呈红色的溶液中:CO32-、NH4+、NO3-、K+ | |
| B. | 含有大量NO3-的溶液中:H+、Na+、Fe2+、Cl- | |
| C. | 强酸性溶液中:Fe3+、NH4+、Cl-、SCN- | |
| D. | 含有NaHSO4的溶液中:K+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 190 | B. | 218 | C. | 436 | D. | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
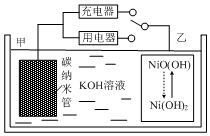 2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )| A. | 放电时,甲电极为正极,OH-移向乙电极 | |
| B. | 放电时,乙电极反应为:Ni(OH)2+OH--e-=NiO(OH)+H2O | |
| C. | 充电时,电池的碳电极与直流电源的正极相连 | |
| D. | 电池总反应为H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以利用铝热反应冶炼高熔点的金属 | |
| B. | 现代石油化工,采作银作催化剂可以实现一步完成乙烯转化为环氧乙烷的过程,该反应的原子利用率为100% | |
| C. | 工业上制溴是向酸化的浓缩海水中直接通入氯气置换出溴即可 | |
| D. | 煤直接液化可得液体燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
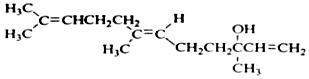 关于橙花醇叙述错误的是( )
关于橙花醇叙述错误的是( )| A. | 可使酸性 KMnO4溶液褪色 | |
| B. | 橙花醇中含有2种官能团 | |
| C. | 在浓硫酸催化下加热脱水,生成的产物不止一种 | |
| D. | 1mol橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗240g溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a+b=14 | B. | a+b=13 | C. | a+b=15 | D. | a+b=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2和稀H2SO4反应 | B. | HNO3和Mg(OH)2反应 | ||
| C. | Ba(OH)2溶液和HCl溶液混合 | D. | NaOH和CH3COOH反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com