
【题目】某研究小组向某2L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g)D(g)+E(g)△H=QkJmol﹣1 . 在T1℃时,反应进行到不同时间测得各物质的物质的量如下表:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(1)T1℃时,该反应的平衡常数K=;
(2)30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是(填字母编号).
a.通入一定量的B
b.加入一定量的固体A
c.适当缩小容器的体积
d.升高反应体系温度
e.同时加入0.2molB、0.1molD,0.1molE
(3)对于该反应,用各物质表示的反应速率与时间的关系示意曲线为如图中的(填序号) 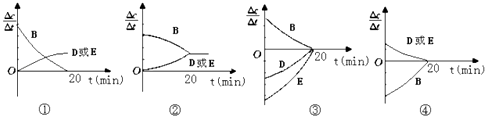
(4)维持容器的体积和温度T1不变,当向该容器中加入1.60molB,0.20molD,0.20molE和nmolA,达到平衡后,与表格中20分钟时各物质的浓度完全相同时,则投入固体A的物质的量n取值范围mol.
(5)维持容器的体积和温度T1不变,各物质的起始物质的量为:n(A)=1.0mol,n(B)=3.0mol,n(D)=amol,n(E)=0mol,达到平衡后,n(E)=0.50mol,则a= .
(6)若该密闭容器绝热,实验测得B的转化率B%随时间变化的示意图如图所示由图可知,Q0(填“大于”或“小于”),c点v正v逆(填“大于”、“小于”或“等于”.) 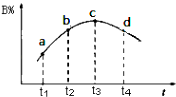
【答案】
(1)0.25
(2)ae
(3)④
(4)>0.3
(5)1.5
(6)小于;等于
【解析】解:(1)由表可知40分钟达平衡状态,结合平衡浓度和平衡常数概念计算,所以K= ![]() =0.25.
=0.25.
所以答案是:0.25;(2)30nim后,BDE都增加,由图可知反应体系反应物和生成物的物质的量都增加,可能增大反应物B的量,平衡正向移动,导致反应物和生成的物质的量都增加,或按变化量同时改变反应物和生成物,
a.通入一定量的B平衡正向进行,BDE增大,故a符合;
b.加入一定量的固体A不影响平衡移动,BDE不变,故b不符合;
c.反应前后气体体积不变,适当缩小容器的体积,平衡不动,故c不符合;
d.反应是吸热反应,升高反应体系温度,平衡正向进行,B减小,故d不符合;
e.同时加入0.2molB、0.1molD、0.1molE,BDE浓度增大,故e符合;
故选:ae;(3)A(s)+2B(g)D(g)+E(g)△H=QkJmol﹣1 . 反应前后气体体积不变;①B的反应速率不能为0;②B的反应速率和DE反应速率达到平衡状态不能相同;③DE变化速率 相同,图象不符;④DE速率相同,图象表示的是逆向进行,B反应速率增大,DE反应速率减小,故④正确
所以答案是:④(4)由提供的数据可知,与表格中20分钟时各物质的浓度完全相同时,所以生成D、E的量为0.5﹣0.2=0.3mol,A的量要够转化所以A的量不小于0.3mol,可逆反应不能完全进行,A虽是固体,但也得有剩余,固体A的物质的量n取值范围大于0.3mol;
所以答案是:>0.3;(5)
A(s) | + | 2B(g) | D(g) | + | E(g) | ||
起始量 | 3.0mol | amol | 0mol | ||||
平衡量 | 3﹣0.5×2 | a+0.50 | 0.50mol |
 =0.25,
=0.25,
解得a=1.5,所以答案是:1.5;(6)最高点达平衡状态,温度升高B的转化率减小,所以正反应是放热反应,即Q小于0,所以答案是:小于;等于.
【考点精析】本题主要考查了化学平衡状态本质及特征和化学平衡的计算的相关知识点,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列物质性质与应用的对应关系错误的是( )
A.硅胶吸水能力强,可用作食品、药品的干燥剂
B.氢氧化铝碱性不强,可用作胃酸中和剂
C.次氯酸钠具有强氧化性,可用作织物的漂白剂
D.葡萄糖具有氧化性,可用于工业制镜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中正确的是( ) 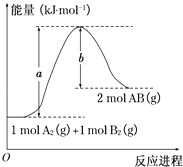
A.每生成2分子AB吸收b kJ热量
B.该反应热△H=+(a﹣b)kJmol﹣1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A﹣A和1 mol B﹣B键,放出a kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们会利用纳米级(1-100nm,1nm=10-9m)微粒物质制造出更加优秀的材料和器件,使化学在材料、能源、环境和生命科学等领域发挥越来越重要的作用。将纳米级微粒物质溶解于液体溶剂中形成一种分散系,对该分散系及分散质颗粒的叙述中正确的是( )
A. 该分散系能发生丁达尔效应 B. 该分散系为溶液
C. 该分散系属于悬浊液 D. 该分散系放置一段时间可能很快出现分层现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 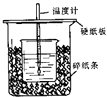
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 .
(2)烧杯间填满碎纸条的作用是 .
(3)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大、偏小、无影响”)
(4)如果用60mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热(填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会;(填“偏大”、“偏小”、“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某溶液中先滴加稀硝酸,再滴加氯化钡,有白色沉淀产生,该溶液
A. 一定含有SO42- B. 一定含有Ag+或SO42-
C. 一定含有SO32- D. 可能含有Ag+或SO42-或SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NCl3可用于漂白,也可用于柠檬等水果的熏蒸处理.已知:NCl3熔点为﹣40℃,沸点为70℃,95℃以上易爆炸,有刺激性气味,可与水反应.实验室中可用氯气和氨气反应制取NCl3 , 反应方程式为4NH3+3C12 ![]() NCl3+3NH4Cl.某校化学兴趣小组同学设计了如图所示的实验装置(NH4Cl的分解温度为300℃左右).
NCl3+3NH4Cl.某校化学兴趣小组同学设计了如图所示的实验装置(NH4Cl的分解温度为300℃左右).
回答下列问题:
(1)写出装置F中的烧瓶内发生反应的离子方程式: . 写出A装置中的试管内发生的反应的化学方程式:
(2)E中的试剂为;B中的试剂为
(3)导管G末端应连接的装置为图中的(填选项字母). 
(4)NCl3遇水可发生水解反应生成两种物质,其中一种是可使湿润的红色石蕊试纸变蓝的气体,另一种有强氧化性,可使有色物质褪色.写出NCl3水解的化学方程式: .
(5)已知C中生成的NH4Cl溶解在NCl3中,欲将二者分离可采取的操作方法为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(多选)恒温下,容积均为2L的密闭容器M,N中,分别有以下列两种起始投料建立的可逆反应3A(g)+2B(g)2C(g)+xD(s)的化学平衡状态,相关数据如下:M:3mol A、2mol B;2min达平衡,生成D 1.2mol,测得从反应开始到平衡C的速率为0.3mol(Lmin)﹣1 . N:2mol C,y mol D;达平衡时c(A)=0.6molL﹣1 . 下列推断的结论中不正确的是( )
A.x=2
B.平衡时M中c(A)<0.6 mol/L
C.y>0.8
D.M,N达到平衡时容器中各物质浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见物质A,B,C,D,E,X,存在下图转化关系 (部分生成物和反应条件略去).下列推断不正确的是( ) ![]()
A.若D是一种强碱,则A,B,C均可与X反应生成D
B.若D为NaCl,且A可与C反应生成B,则E可能是CO2
C.若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
D.若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com