
| A. | 密闭、低温是存放氨水的必要条件 | |
| B. | 实验室常用排饱和食盐水法收集氯气 | |
| C. | 硫酸工业生产中,使用过量空气以提高SO2的利用率 | |
| D. | 合成氨反应采用催化剂以提高氨气的生产效率 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A、氨水中存在NH3+H2O?NH3.H2O?NH4++OH-,一水合氨不稳定,升高温度易分解,所以需要密封、低温保存,可以用勒夏特里原理解释,故A不选;
B、氯气和水反应存在Cl2+H2O?HCl+HClO,食盐水中含有氯离子抑制氯气溶解,所以可以采用排饱和食盐水的方法收集氯气,可以用勒夏特里原理解释,故B不选;
C、根据平衡:2SO2+O2?2SO3,使用过量的空气即增大氧气的量可以使化学平衡正向移动,提高SO2的利用率,能用勒沙特列原理解释,故C不选;
D、工业合成氨时选择铁做催化剂能极大加快反应速率,不涉及化学平衡移动知识,不能用勒沙特列原理解释,故D选.
故选D.
点评 本题考查勒夏特里原理,侧重考查基本理论,明确勒夏特里原理适用范围即可解答,会利用勒夏特里原理解释外界条件对化学平衡的影响,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
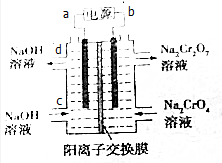 已知反应:2CrO42-+2H+?Cr2O72-+H2O.某科研小组用如图电解装置,由Na2CrO4溶液制取Na2Cr2O7溶液.下列有关叙述正确的是( )
已知反应:2CrO42-+2H+?Cr2O72-+H2O.某科研小组用如图电解装置,由Na2CrO4溶液制取Na2Cr2O7溶液.下列有关叙述正确的是( )| A. | CrO42-生成Cr2O72-的反应为非氧化还原反应,不能通过电解方法获得 | |
| B. | a为电源正极 | |
| C. | d口流出的NaOH溶液的浓度与c口通入的NaOH溶液的浓度相同 | |
| D. | Na+从右侧通过阳离子交换膜进入左侧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+H+ AlO2- SO32- | B. | NH4+ Al3+SO42-Cl- | ||
| C. | OH- K+ SO42- HCO3- | D. | Fe2+Na+ ClO-NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠不能用于治疗胃溃疡病人的胃酸过多症 | |
| B. | 切开的金属Na暴露在空气中,光亮表面会逐渐变暗 | |
| C. | 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔 | |
| D. | 金属镁在空气中燃烧的产物是纯净的氧化镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 7.5 mL | B. | 17.5 mL | C. | 25.0 mL | D. | 35.0 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com