
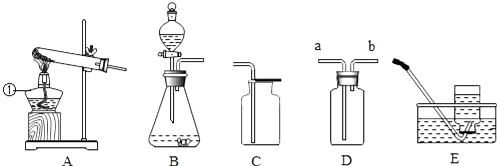
分析 (1)依据仪器①形状说出其名称;
(2)氯酸钾在二氧化锰做催化剂条件下分解生成氯化钾和氧气,为防止防止冷凝水回流炸裂试管,所以加热时试管口应略向下倾斜;实验室制备氧气可用加热分解高锰酸钾法和用二氧化锰做催化剂分解过氧化氢的方法;
(3)实验室常用块状固体硫化亚铁(FeS)和稀硫酸在常温下制取硫化氢气体,因此不需要加热;硫化氢密度大于空气密度,应采用向上排空气法收集,应长进短出;硫化氢与氢氧化钠反应生成硫化钠和水.
解答 解:(1)依据仪器①形状可知,该仪器为:酒精灯;
故答案为:酒精灯;
(2)氯酸钾在二氧化锰做催化剂条件下分解生成氯化钾和氧气,方程式:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,为防止防止冷凝水回流炸裂试管,所以加热时试管口应略向下倾斜;实验室制备氧气可用加热分解高锰酸钾法,方程式:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,还可以用二氧化锰做催化剂分解过氧化氢的方法,方程式:2H2O2$\frac{\underline{\;二氧化锰\;}}{\;}$2H2O+O2↑;
故答案为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;防止防止冷凝水回流炸裂试管;2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;2H2O2$\frac{\underline{\;二氧化锰\;}}{\;}$2H2O+O2↑;
(3)实验室常用块状固体硫化亚铁(FeS)和稀硫酸在常温下制取硫化氢气体,因此不需要加热,选B作为发生装置;硫化氢密度大于空气密度,应采用向上排空气法收集,应长进短出,气体应从a端通入;硫化氢与氢氧化钠反应生成硫化钠和水,化学方程式:H2S+2NaOH=Na2S+2H2O;
故答案为:B;a;H2S+2NaOH=Na2S+2H2O.
点评 本题为实验题,考查了实验室制备氧气、硫化氢气体,明确反应原理及装置选择依据是解题关键,题目难度不大.


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
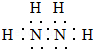 ,其中氮的化合价为-2.
,其中氮的化合价为-2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol | B. | 0.4 mol | C. | 0.6 mol | D. | 0.8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 短周期是指第1、2周期 | B. | 过渡元素全部是金属元素 | ||
| C. | 元素周期表有8个副族 | D. | IA族的元索全部是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个氮气分子与3NA个氢气分子恰好生成2NA个氨气分子 | |
| B. | 在1L0.1mol/L的AICI3溶液中含有0.1NA个AI3+ | |
| C. | 常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2NA | |
| D. | 5.6g的铁与足量的稀硝酸反应转移的电子数是0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为SO2有漂白性,所以它能使品红溶液、溴水褪色 | |
| B. | 能使品红溶液褪色的气体不一定是SO2 | |
| C. | SO2、HClO、活性炭都能使红墨水褪色,其原理相同 | |
| D. | SO2和Cl2都有漂白作用,将两种气体同时作用于湿润的有色布条,漂白效果更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
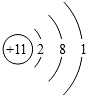 ;A元素电子排布式1s22s22p63s23p4;
;A元素电子排布式1s22s22p63s23p4;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com