考点:反应热和焓变,阿伏加德罗常数,化学方程式的有关计算,分子晶体
专题:
分析:A、硫固体变为蒸汽的过程是吸热的过程;
B、分子晶体是分子间通过分子间作用力(包括范德华力和氢键)构成的晶体.常见的分子晶体有:所有非金属氢化物、部分非金属单质(金刚石、晶体硅等除外)、部分非金属氧化物(二氧化硅等除外)、几乎所有的酸、绝大多数的有机物晶体、所有常温下呈气态的物质、常温下呈液态的物质(除汞外)、易挥发的固态物质等;
C、根据例子:氧气和钠反应可以生成氧化钠,也可以生成过氧化钠来解答;
D、Fe先与CuSO4反应,再与H2SO4反应,根据反应的顺序和相关的量进行计算.
解答:
解:A、硫固体变为蒸汽的过程是吸热的过程,等量的硫蒸汽和硫固体分别完全燃烧,恢复到原状态,前者放出的热量多,故A正确;
B、I
2、SO
3、固态氩都是分子间通过分子间作用力(包括范德华力和氢键)构成的晶体,属于分子晶体,故B正确;
C、氧气和钠反应可以生成氧化钠,也可以生成过氧化钠,2mol O
2与金属钠反应,反应生成氧化钠电子转移4mol,生成过氧化钠电子转移2mol,O
2不一定得到4N
A个电子,故C错误;
D、ag铁粉为
mol,agCu为
mol,根据氧化还原顺序Fe先与CuSO
4反应,再与H
2SO
4反应,因为
mol>
mol,
所以CuSO
4反应完全,剩余Fe与H
2SO
4反应,
所以参加反应的CuSO
4的物质的量为
mol,
参加反应的H
2SO
4的物质的量为(
-
)mol,
参加反应的CuSO
4和H
2SO
4的物质的量之比为:
:(
-
)=7:1,故D错误.
故选CD.
点评:本题涉及反应热和焓变的关系、分子晶体的概念、电子转移以及方程式的计算等知识,注意知识的归纳和梳理是关键,难度中等.



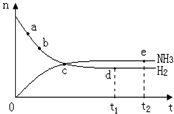 合成氨工业对国民经济和社会发展具有重要的意义,对密闭容器中的反应:
合成氨工业对国民经济和社会发展具有重要的意义,对密闭容器中的反应: