
用某仪器量一液体体积时,平视时体积为V1ml,仰视读数为V2ml,俯视读数为V3ml,若V3>V1>V2,则所使用的仪器可能是 ( )
A. 容量瓶 B. 量筒 C. 碱式滴定管 D. 以上仪器均可
科目:高中化学 来源:广西南宁市2017届高三第一次模拟测试理综化学试卷 题型:填空题
偏钒酸铵(NH4VO3)主要用作催化剂、催干剂、媒染剂等。用沉淀法除去工业级偏钒酸铵中的杂质硅、磷的流程如下:
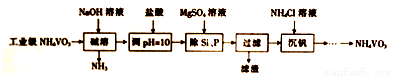
(1)碱溶时,下列措施有利于NH3逸出的是_____(填字母)。
A.升高温度 B.增大压吸 C.增大NaOH溶液的浓度
(2)①滤渣的主要成分为Mg3(PO4)2、MgSiO3,已知Ksp(MgSiO3)=2.4×l0-5.若滤液中c(SiO32-)=0.08mol/L,则c(Mg2+)=__________。
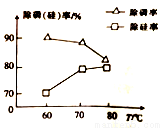
②由图可知,加入一定量的MgSO4溶液作沉淀剂时,随着温度的升高,除磷率下降,其原因是温度升高,Mg3(PO4)2溶解度增大和_______;但随着温度的升高,除硅率升高,其原因是______(用离子方程式表示)。
(3)沉钒时,反应温度需控制在50℃,在实验室可采取的加热方式为_______。
(4)探究NH4Cl的浓度对沉钒率的影响,设计实验步骤(常见试剂任选):取两份10mL一定浓度的滤液A和B,分别加入lmL和10mL的1mol/LNH4Cl溶液,再向A中加入_______mL蒸馏水,控制两份溶液温度均为50℃、pH均为8,由专用仪器洲定沉钒率。加入蒸馏水的目的是______。
(5)偏钒酸铵本身在水中的溶解度不大,但在草酸(H2C2O4)溶液中因发生氧化还原反应而溶解,同时生成络合物(NH4)2[(VO)2(C2O4)3],该反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源:2017届福建省厦门市高三下学期第一次质量检测理综化学试卷(解析版) 题型:简答题
软锰矿的主要成分是MnO2,其悬浊液可吸收烟气中SO2,所得酸性浸出液又可用于制备高纯硫酸锰,其一种工艺流程如右图所示。回答下列问题:
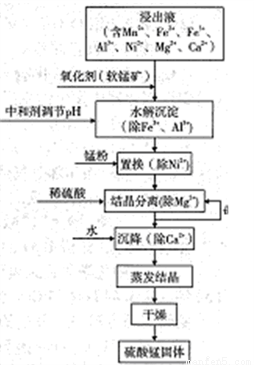
(1)软锰矿悬浊液吸收SO2的过程中,SO2体现了________性。
(2)“氧化剂”发生反应的离子方程式为____________。
(3)已知:Ksp[Al(OH) 3]=1.0×10-34;
Krp[Fe(OH) 3]=2.6×10-30;
Krp[Ni(OH) 2]=1.6×10-15;
Krp[Mn(OH) 2]=4.0×10-14;
“水解沉淀“中:
①“中和剂“可以是________(填标号)
A.Al2O3 B.H2SO4 C.MgO D.MnO2
②溶液的pH应不低于________(离子浓度小于1×10-5mol·L-1时,即可认为该离子沉淀完全)
③不采用“水解沉淀“除Ni2+的原因是___________。
(4)“置换”中发生反应的离子方程式为____________。
(5)“结品分离”中的部分物质的溶解度曲线如右图。
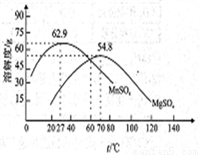
①加入稀硫酸的作用是(结合平衡移动原理解释)_____________。
②结晶与过滤过程中,体系温度均应维持在_______℃(填“27”、“60”或“70”)。
(6)高纯硫酸锰可用于水中溶解氧含量的测定,步骤如下:
步骤1:水中的氧气在碱性溶液中将MnSO4氧化为MnO(OH)2。
步骤2:在酸性条件下,加入KI将生成的MnO(OH)2再还原成Mn2+。
步骤3:用Na2S2O3标准溶液滴定步骤2中生成的I2(2S2O32-+I2=2I-+S4O62-)。
取某水样100mL,按上述测定步骤滴定,消耗a mol·L-1 NaS2O3标准溶液VmL,该水样溶解氧含量为
_________mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都简阳市高二上学期期末检测化学试卷(解析版) 题型:选择题
下列有关方程式书写正确的是( )
A.醋酸溶液与氢氧化钠溶液反应的离子方程式为H++OH-=H2O
B.H2S在水溶液中的电离:H2S+H2O H3O++ HS-
H3O++ HS-
C.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4 (g)+2O2 (g) == CO2 (g)+2H2O (g) ΔH=-890.3 kJ·mol-1
D.双氧水中加入稀硫酸和KI溶液: H2O2+ 2I-+H+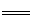 I2+ 2H2O
I2+ 2H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都简阳市高二上学期期末检测化学试卷(解析版) 题型:选择题
如下图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g) 2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3molA和1molB,则达到平衡时各容器中C物质的体积分数由大到小的顺序为 ( )
2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3molA和1molB,则达到平衡时各容器中C物质的体积分数由大到小的顺序为 ( )
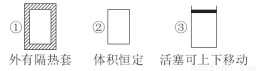
A.③②① B.③①② C.①②③ D.②①③
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都简阳市高二上学期期末检测化学试卷(解析版) 题型:选择题
用VSEPR模型预测下列分子或离子的立体结构,其中正确的是 ( )
A. H2O与BeCl2为角形(V形) B. CS2与SO2为直线形
C. SO3与CO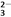 为平面三角形 D. BF3与PCl3为三角锥形
为平面三角形 D. BF3与PCl3为三角锥形
查看答案和解析>>
科目:高中化学 来源:山东省2016-2017学年高一3月月考化学试卷 题型:选择题
X、Y、Z三种短周期元素,原子半径的大小关系为:r(y)>r(x)>r(z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生下图所示变化,其中B和C均为10电子分子。下列说法不正确的是
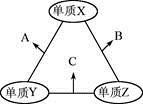
A. X元素位于ⅥA
B. A不能溶解于B中
C. B的沸点高于C的沸点
D. A和C不可能发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2017届陕西省咸阳市高三二模理综化学试卷(解析版) 题型:推断题
以A、B为原料制备线型高分子化合物M和抗凝血药N的一种路线如下(部分反应条件和试剂略去):
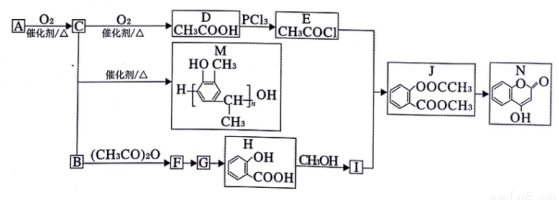
已知:I. 烃A的密度是相同条件下H2密度的14倍;
I.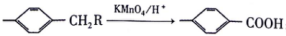
II. 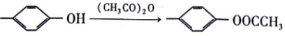
请回答下列问题:
(1)B的化学名称为____。F的结构简式为______。
(2)N中含氧官能团的名称为 _______。
(3)D→E的反应类型为_____。
(4)I的核磁共振氢谱中有_______组吸收峰。G分子中最多有____个原子共平面。
(5)B+C→M的化学方程式为_______。
(6)同时满足下列条件的J的同分异构体有_____种(不考虑立体异构)。
①苯环上连有2个取代基
②1mol该物质与足量的NaHCO3反应,生成2molCO2
(7)参照上述信息和合成路线,以HO CH3和(CH3CO)2O为起始原料(其他无机试剂任选),设计制备
CH3和(CH3CO)2O为起始原料(其他无机试剂任选),设计制备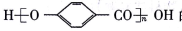 的合成路线 _______。
的合成路线 _______。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南京市、盐城市高三第二次模拟考试化学试卷(解析版) 题型:选择题
下列反应的离子方程式正确的是
A. 铜跟稀HNO3反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
B. 向硫酸铝溶液中加入过量氨水:Al3++3OH-= AlO2-+2H2O
C. 向Ag(NH3)2NO3溶液中加入盐酸:Ag(NH3)2++2H+=Ag++2NH4+
D. NaHSO4溶液和Ba(OH)2溶液混合后溶液呈中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com