
�мס������������������ݻ��̶����������ݻ��ɱ䡣һ���¶��£��ڼ��м���2 mol N2��3 mol H2����ӦN2(g)��3H2(g)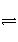
 2NH3(g)�ﵽƽ��ʱ����NH3�����ʵ���Ϊm mol��
2NH3(g)�ﵽƽ��ʱ����NH3�����ʵ���Ϊm mol��
(1)��ͬ�¶��£������м���4 mol N2��6 mol H2�����ҵ�ѹǿʼ�����ѹǿ��ȣ����з�Ӧ�ﵽƽ��ʱ������NH3�����ʵ���Ϊ________mol(�����и�����ѡ��ֻ����ţ���ͬ)�����ҵ��ݻ�����ݻ�ʼ����ȣ����з�Ӧ�ﵽƽ��ʱ������NH3�����ʵ���Ϊ________mol��
A��С��m B������m C����m��2m֮�� D������2m E������2m
(2)��ͬ�¶��£������ҵ��ݻ�Ϊ��һ�룬������1 mol NH3��Ҫʹ���з�Ӧ�ﵽƽ��ʱ�����ʵ���������������������дﵽƽ��ʱ��ͬ������ʼӦ����______mol N2��________mol H2��
(1)D��E��(2)0.5��0
������(1)���ڼ��������ݣ�����������ѹ�����ǵ�ѹǿ��ȣ��ﵽƽ��ʱ���ҵ��ݻ�Ӧ��Ϊ�����������ɵ�NH3�����ʵ���Ӧ�õ���2m�����ס�����������������ʱ���൱�ڽ�������Чƽ����������ѹ����������NH3�����ʵ�������2m��
(2)�ҵ��ݻ�Ϊ��һ��ʱ��Ҫ�������һ����ƽ�⣬ֻ�����е�Ͷ�����Ǽ�һ����У�������Ӧ��Ͷ��N2Ϊ(1��0.5) mol��0.5 mol��H2Ϊ(1.5��1.5) mol��0 mol��


 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д� �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
±�������±��ԭ��������ý��������ӽ�ϣ��������з�Ӧ��R—X��NaCN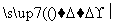 R—CN��NaX��R—X��2Na��X—R��
R—CN��NaX��R—X��2Na��X—R��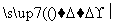 R—R�䣫2NaX��
R—R�䣫2NaX��
�������и����ʵ�ת����ϵ�ش�
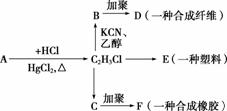
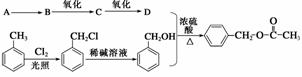
(1)A�ķ���ʽ��________��E�Ľṹ��ʽ��________________________________________________________________________��
(2)д��B��D�Ļ�ѧ����ʽ��________________________________________________________________________
________________________________________________________________________��
(3)д��C2H3Cl��C�Ļ�ѧ����ʽ��________________________________________________________________________
________________________________________________________________________��
(4)д��C��F�Ļ�ѧ����ʽ��________________________________________________________________________
________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ᱽ�������������ķ�����ζ�������ڻ�ױƷ��ҵ��ʳƷ��ҵ����ͼ�����ᱽ������һ�ֺϳ�·��(���ַ�Ӧ�����ͷ�Ӧ������ȥ)��
��ش�
(1)������ϳɷ������ƶϣ�C�Ľṹ��ʽΪ
________________________________________________________________________��
(2)
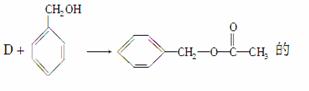
��ѧ����ʽΪ
________________________________________________________________________
________________________________________________________________________��
(3)��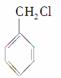 ��Ϊͬ���칹��ķ��㻯������________�֣�����һ��ͬ���칹��ĺ˴Ź�������������������ԭ�ӵ����շ壬��ͬ���칹��Ľṹ��ʽΪ________________��
��Ϊͬ���칹��ķ��㻯������________�֣�����һ��ͬ���칹��ĺ˴Ź�������������������ԭ�ӵ����շ壬��ͬ���칹��Ľṹ��ʽΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��1 mol���������л���A�����������������ӳɷ�Ӧ����ӳɲ�����2,2,3�������飬����л���A���ܵĽṹ��ʽΪ________________________________
________________________________________________________________________
________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͼ��ʾ�ݻ��̶����ܱ������н��е�ijһ���淴Ӧ��A(g)��2B(g)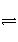
 2C(g)����BŨ�ȱ�ʾ��Ӧ������ʱ��Ĺ�ϵ����֪���ʵ�λΪmol��L��1��s��1��ͼ����Ӱ�������ֵ�൱��(����)
2C(g)����BŨ�ȱ�ʾ��Ӧ������ʱ��Ĺ�ϵ����֪���ʵ�λΪmol��L��1��s��1��ͼ����Ӱ�������ֵ�൱��(����)
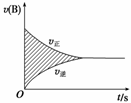
A��AŨ�ȵļ����� B��BŨ�ȵļ�����
C��C���ʵ����������� D��B���ʵ����ļ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
2007��10��10�գ��¹���ѧ�Ҹ���¡����������յĵ�������ŵ������ѧ�����Խ������ڱ��滯ѧ���������Ŀ����Թ��ס��ϳɰ���Ӧ���������������ʱЧ��������ߣ����ǰ����ص��о��ɹ������й��ںϳɰ���Ӧ�������У���ȷ����(����)
A�����������ɼӿ췴Ӧ���ʣ���������ƽ����ϳɰ��ķ����ƶ�
B�������ӻ�����з��룬�ɼӿ췴Ӧ���ʣ���������ƽ����ϳɰ��ķ����ƶ�
C�������¶ȿ��Լӿ췴Ӧ���ʣ���������ƽ����ϳɰ��ķ����ƶ�
D������ѹǿ�ɼӿ췴Ӧ���ʣ���������ƽ����ϳɰ��ķ����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����Ṥҵ�У�ͨ�����з�ӦʹSO2������SO3��
2SO2(g)��O2(g)
 2SO3(g)����H����198 kJ��mol��1��(��֪��SO3�����д�����V2O5������400�桫500��ʱ��Ч�����)
2SO3(g)����H����198 kJ��mol��1��(��֪��SO3�����д�����V2O5������400�桫500��ʱ��Ч�����)
�±�Ϊ��ͬ�¶Ⱥ�ѹǿ��SO2��ת����(%)��
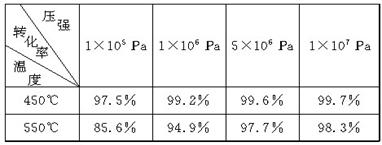
(1)���ݻ�ѧ�����ۺϷ�����Ϊ��ʹ����������ת��Ϊ�������ɿ��Ƶ�������________________________________________________________________________��
(2)ʵ�������У�ѡ��400�桫500����Ϊ�����¶ȣ���ԭ����
________________________________________________________________________��
ʵ�������У����õ�ѹǿΪ��ѹ����ԭ����
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________��
�������У�ͨ�����������Ŀ����
________________________________________________________________________
________________________________________________________________________��
(5)�����SO2�������������
________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���з�Ӧ�����ӷ���ʽ�д�����ǣ���
| A�� | �Ȼ�����Һ�м�������İ�ˮAl3++3NH3•H2O=Al��OH��3��+3NH4+ | |
| B�� | ��Ƭ���������ϡ������3Fe+8H++2NO3��=3Fe2++2NO2��+4H2O | |
| C�� | ����Ƭ�������NaOH��Һ��2Al+2OH+2H2O=2AlO2��+3H2�� | |
| D�� | ƫ��������������ᷴӦAlO2��+4H+=Al3++2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����������ڷ�����Ӧ������ʹ��ˮ��ɫ������ʹ����KMnO4��Һ��ɫ����(����)
A������ B����ϩ
C���� D���ױ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com