
某温度下,反应2A(g) B(g) ΔH>0在密闭容器中达到平衡,平衡后
B(g) ΔH>0在密闭容器中达到平衡,平衡后 =a,若改变某一条件,足够时间后反应再次达到平衡状态,此时
=a,若改变某一条件,足够时间后反应再次达到平衡状态,此时 =b,下列叙述正确的是( )
=b,下列叙述正确的是( )
A.若a=b,则容器中可能使用了催化剂或恒温恒容下充入惰性气体
B.在该温度下,保持容积固定不变,向容器内补充了B气体,则a<b
C.若其他条件不变,升高温度,则a<b
D.若保持温度、压强不变,充入惰性气体,则a>b
科目:高中化学 来源:2016-2017学年湖南省高二上10月月考化学卷(解析版) 题型:选择题
一定温度下,向容积为4 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
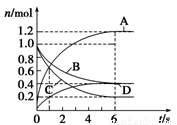
A.该反应的化学方程式为3B+4D  6A+2C
6A+2C
B.反应进行到6 s时,B的平均反应速率为0.025 mol/(L·s)
C.反应进行到6 s时,各物质的反应速率相等
D.反应进行到1 s时,v(A)=v(D)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高二上月考一化学试卷(解析版) 题型:填空题
2016年9月3日,二十国集团领导人杭州峰会之前,中国政府率先签署了《巴黎协定》并向联合国交存批准文书,体现中国为应对全球气候变化做出了重要贡献。为减少CO2对环境造成影响,有科学家提出设想,先把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,并使之变为可再生燃料甲醇,流程如下:
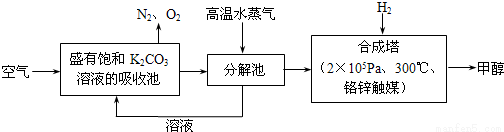
(1)写出分解池中反应的化学方程式___________________。
(2)在合成塔中,当有8.8gCO2与足量H2完全反应,可放出9.84×l03kJ的能量,写出合成塔中反应的热化学方程式______________________。
(3)在体积为l L的密闭容器中,充入1molCO2和3molH2在300℃下发生反应,有关物质的浓度随时间变化如下图所示。
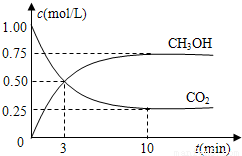
①从反应开始到平衡,H2的平均反应速率v(H2)=_______ _____。
②其他条件不变,只将温度提高到500℃,再次平衡时n(CH3OH)/n(CO2)比值___________(填“增大”、“减小”或“不变”)。
③从平衡移动原理分析,低温有利于提高原料气的转化率,而实际生产中采用300℃的温度,原因是_______________。
(4)目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H>0。
CH3OCH3(g)+3H2O(g) △H>0。
判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是_________。
a.容器中密度不变
b.单位时间内消耗2molCO2,同时消耗1mol二甲醚
c.v(CO2):v(H2)=1:3
d.容器内压强保持不变
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高二上月考一化学试卷(解析版) 题型:选择题
白磷和红磷都是磷元素的单质,已知31g红磷完全转化成白磷时,要吸收E kJ的能量,下列说法正确的是( )
A.白磷不如红磷稳定
B.等质量时,红磷能量高于白磷
C.红磷转化成白磷不属于化学变化
D.等质量的红磷与白磷完全燃烧,白磷放出的能量少
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上9月月考化学试卷(解析版) 题型:填空题
碳及其化合物与人类的生活、生产紧密联系。
(1)已知1g甲烷完全燃烧生成稳定的氧化物时放出Q kJ的热量,写出表示甲烷燃烧热的热化学方程式:
(2)已知:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+130 kJ·mol-1,
2C(s)+O2(g)=2CO(g) ΔH=-220 kJ·mol-1。断开1 mol H—H键、O===O键分别需要吸收436 kJ、496 kJ的热量,则断开1 mol O—H键需要吸收的热量为
A.332 kJ B.118 kJ
C.462 kJ D.360 kJ

(3)以CO2和H2O为原料制备HCOOH和O2的原电池原理如图.电极a、b表面发生的电极反应式分别为:
a: ,b: .

(4)图中用石墨作电极,在一定条件下电解饱和食盐水制取ClO2气体。则阳极产生ClO2的电极反应式为_______________________,用平衡移动原理解释阴极区pH增大的原因:_____________。
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上9月月考化学试卷(解析版) 题型:选择题
下列有关反应热的叙述中正确的是( )
A.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1
B.X(g)+Y(g) Z(g)+W(s) ΔH>0,升高温度,该反应的ΔH增大
Z(g)+W(s) ΔH>0,升高温度,该反应的ΔH增大
C.已知:S(s)+O2(g)=SO2(g) ΔH1,S(g)+O2(g)=SO2(g) ΔH2 则 ΔH1>ΔH2
D.甲中加入1 g SO2、1 g O2,乙中加入2 g SO2、2 g O2,在恒温恒容或恒温恒压下反应2SO2(g)+O2(g) 2SO3(g)达平衡时,乙放出的热量都等于甲的2倍
2SO3(g)达平衡时,乙放出的热量都等于甲的2倍
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上9月月考化学试卷(解析版) 题型:选择题
实验室欲配制100mL l.0mol/L Na2CO3溶液,下列操作正确的是( )
A. 用托盘天平称量Na2CO3•10H2O晶体10.6g,倒入烧杯中加适量的水溶解
B. 当烧杯中固体全部溶解后,立即用玻璃棒引流转移至容量瓶中
C. 定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分
D. 若配制时,俯视液面定容,所配溶液的浓度偏高,再补加少量蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一上月考一化学试卷(解析版) 题型:选择题
水资源非常重要,联合国确定2003年为国际淡水年。海水淡化是海岛地区提供淡水的重要手段,所谓海水淡化是指除去海水中的盐分以获得淡水的工艺过程(又称海水脱盐),其方法较多,如反渗透法 、水合物法、电渗透法、离子交换法和压渗法等.下列方法中也可以用来进行海水淡化的是( )
A.过滤法 B.萃取法 C.分液法 D.冰冻法
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一上10月月考化学卷(解析版) 题型:推断题
目前,世界上多采用电解熔融氯化钠的方法来生产金属钠:2NaCl(熔融) 2Na+Cl2。己知物质A、B、C、D、E、F有如下图所小转化关系:
2Na+Cl2。己知物质A、B、C、D、E、F有如下图所小转化关系:

(1)试根据上述变.化写出A、B、C、D、E、F的化学式:
A_______________,B_______________,C _________________,
D_____________,E _____________,F________________.
(2)请写出A→C 以及B →D 两个反应的化学方程式。
①A→C________________________________,
②B→D_________________________________.
(3)过氧化钠可用作制氧剂,写出过氧化钠与二氧化碳反应的化学方程式:_____________.
(4)工业上制取漂白粉的化学方程式为________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com