
| A、能够发生有效碰撞的分子一定是活化分子 |
| B、增大浓度,单位体积内活化分子数增加,化学反应速率增大 |
| C、加入反应物,使活化分子百分数增大,化学反应速率增大 |
| D、一般使用催化剂可以降低反应的活化能,增大活化分子百分数,增大化学反应速率 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡向正向移动 |
| B、重新达到平衡时PCl5转化率增大 |
| C、重新达到平衡后PCl3体积分数减小 |
| D、反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
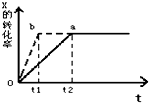 图中a曲线表示一定条件下的可逆反应:X(g)+Y(g)?2Z(g)+W(g);△H=QkJ/mol 的反应过程. 若使a曲线变为b曲线,可采取的措施是( )
图中a曲线表示一定条件下的可逆反应:X(g)+Y(g)?2Z(g)+W(g);△H=QkJ/mol 的反应过程. 若使a曲线变为b曲线,可采取的措施是( )| A、增大Y的浓度 |
| B、加入催化剂 |
| C、降低温度 |
| D、增大体系压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大力发展电动车,减少燃油汽车的尾气排放量 |
| B、燃煤时加入适量石灰石,可减少废气中SO2的排放量 |
| C、多环芳烃是强致癌物,能吸附在PM2.5的表面进入人体 |
| D、PM2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com