
 如图是实验室制乙酸乙酯的装置.
如图是实验室制乙酸乙酯的装置.| 实际产量 |
| 理论产量 |
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
| 2.2g |
| 3.52g |


科目:高中化学 来源: 题型:
| A、Cu+HNO3(浓)→Cu(NO3)2+NO2↑ |
| B、Cu+HNO3 (稀)→Cu(NO3)2+NO↑+H2O |
| C、Cu+O2→CuO,CuO+HNO3 (稀)→Cu(NO3)+H2O |
| D、Cu+AgNO3→Cu(NO3)2+Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、2KClO3
| ||||
B、2P+5Cl2
| ||||
C、MnO2+4HCl(浓)
| ||||
D、H2+Cl2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
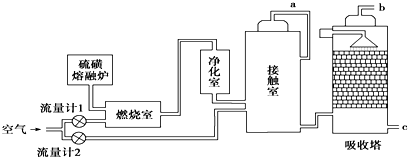
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、维生素A是一种酚 |
| B、维生素A的一个分子中有30个氢原子 |
| C、维生素A的一个分子中有6个不饱和碳原子 |
| D、维生素A分子中处于四面体中心的碳原子有9个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 所示
所示
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、③④ |
| C、①③④ | D、①②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com