
【题目】在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g·mol-1) |
蔗糖 | 25.00 | 342 |
硫酸钾 | 0.87 | 174 |
阿司匹林 | 0.17 | 180 |
高锰酸钾 | 0.316 | 158 |
硝酸银 | 0.075 | 170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是__________________。
A.蔗糖B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)配制上述1L上述“鲜花保鲜剂”所需的仪器有:量筒、玻璃棒、药匙、烧杯、托盘天平、__________________、__________________(在横线上填写所缺仪器的名称),需要高锰酸钾___________mol。
(3)在溶液配制过程中,下列操作对配制结果没有影响的是___________________。
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(4)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为________mol·L-1。
【答案】A 胶头滴管 1000mL容量瓶 0.004 BD 0.024
【解析】
(1)电解质指在溶液中或熔融状态下能导电的化合物,在溶液中和熔融状态下都不能导电的化合物属于非电解质,常见非电解质包括:非金属氧化物、大多数有机物(如乙醇、葡萄糖等)、氨气等;
(2)根据实验操作的步骤(计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签)以及每步操作需要仪器确定反应所需仪器分析;根据500mL“鲜花保鲜剂”中需要高锰酸钾质量分析需要高锰酸钾物质的量;
(3)根据c=![]() 分析操作对溶质的物质的量或对溶液的体积的影响判断,溶质减少,浓度偏小,体积偏大,浓度偏小;
分析操作对溶质的物质的量或对溶液的体积的影响判断,溶质减少,浓度偏小,体积偏大,浓度偏小;
(4)求出K+的物质的量、根据溶液的体积,利用物质的量浓度的公式来计算。
(1)A.蔗糖含有蔗糖分子,在水溶液中,不能电离,只存在分子,不能导电,是非电解质,故A正确;
B.硫酸钾,能电离出硫酸根离子和钾离子,能导电,是化合物,是电解质,故B错误;
C.高锰酸钾是盐,能在水溶液中和熔融状态下电离出自由移动的离子而导电,是电解质,故C错误;
D.硝酸银,溶于水溶液中或在熔融状态下就能够导电,是电解质,故D错误;
故答案为:A;
(2)配制顺序是:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶→贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,冷却后转移到1000mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒23次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线12cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀。所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、1000mL容量瓶、胶头滴管,500mL“鲜花保鲜剂”中需要高锰酸钾0.316g,物质的量为![]() =0.002mol,配制1L溶液需0.004mol,故答案为:胶头滴管、1000mL容量瓶;0.004;
=0.002mol,配制1L溶液需0.004mol,故答案为:胶头滴管、1000mL容量瓶;0.004;
(3)A.定容时俯视容量瓶刻度线,溶液未达到刻度线,体积偏小,浓度偏大,故A错误;
B. 容量瓶在使用前未干燥,里面有少量蒸馏水,不影响溶液的体积,所以浓度不变,故B正确;
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净,容量瓶中沾有溶质,溶质的质量偏大,浓度偏大,故C错误;
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理,过会儿,滞留在刻度线以上的溶液将会下落,正好与刻度线相平,不影响溶液的体积,浓度不变,故D正确;
故选:BD;
(4)K2SO4的物质的量为:![]() =0.005mol,则K+的物质的量为0.01mol,KMnO4的物质的量为
=0.005mol,则K+的物质的量为0.01mol,KMnO4的物质的量为![]() =0.002mol,则K+的物质的量为0.002mol,所以溶液中的K+总共为0.012mol,其物质的量浓度为0.012mol×0.5L=0.024mol/L,故答案为:0.024。
=0.002mol,则K+的物质的量为0.002mol,所以溶液中的K+总共为0.012mol,其物质的量浓度为0.012mol×0.5L=0.024mol/L,故答案为:0.024。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. O2、O3 是氧元素的同素异形体,性质都相似
B. 35Cl与37Cl-互为同位素
C. 乙二醇( ![]() ) 和甘油(
) 和甘油( ![]() )互为同系物
)互为同系物
D. CH3CHO 与![]() 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。
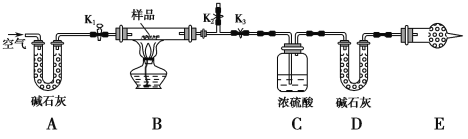
(1) 实验步骤:
① 按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是____________________。
② 称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是___________________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为___________________________、______________________________。
⑤ 打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2) 关于该实验方案,请回答下列问题。
① E处干燥管中盛放的药品是________,其作用是______________________________________,如果实验中没有该装置,则可能导致测量结果NaHCO3的质量分数________(填“偏大”“偏小”或“无影响”)。
② 若样品质量为w g,反应后C、D装置增加的质量分别为m1 g、m2 g,则混合物中Na2CO3·10H2O的质量分数为__________________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于同分异构体(不考虑立体异构)的数目判断正确的是( )
选项 | A | B | C | D |
分子式(或结构简式) | C5H10O2 | C5H10 |
| C7H16 |
已知条件 | 能与碳酸氢钠反应 | 能使溴 水褪色 | 一氯代物 | 分子中含 有3个甲基 |
同分异构体数目 | 4 | 3 | 4 | 5 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ka(CH3COOH)=1.75×10-5, Ka (HCN)=6.2×10-10,下列说法正确的是
A. 0.1mol/L CH3COONa溶液与0.1mol/L KCN溶液:c(Na+)-c(CH3COO-)> c(K+)-c(CN-)
B. 20mL0.1 mol/L CH3COONa与10mL 0.1 mol/L HCl溶液混合后所得酸性溶液:c(Na+)>c(CH3COOH)>c(CH3COO-)
C. 0.2 mol/LHCN溶液与0.1 mol/L NaOH溶液等体积混合所得溶液:c(Na+)>c(CN-)>c(OH-)>c(H+)
D. 向浓度均为0.1mol/L的CH3COOH和HCN混合溶液中滴加0.1mol/LNaOH溶液,当恰好中和时所得溶液: c(CH3COOH)+c(HCN)+c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
![]()
从A出发发生图示中的一系列反应,其中B和C按1:2反应生成Z。F和E按1:2反应生成W,F的核磁共振氢谱只有两种峰,W和Z互为同分异构体。
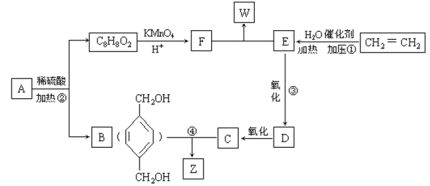
回答下列问题:
(1)写出反应类型:①_____________________,②______________________________。
(2)写出下列反应的化学方程式:
③_____________________________________________________;
④_____________________________________________________。
(3)与B互为同分异构体,属于酚类且苯环上只有两个取代基的化合物有___种(不包括对映异构体)。
(4)A的结构简式可能为_________________________________。
(5)已知酯与醇有如下反应:
RCOOR′+R″OH![]() RCOOR″+R′OH(R、R′、R″代表烃基)
RCOOR″+R′OH(R、R′、R″代表烃基)
B与W在上述条件下可形成高分子化合物Q,请写出B与W生成Q的化学方程式________。
(6)同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮:
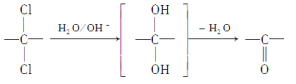
根据已有知识并结合相关信息,写出以对二甲苯为原料(其他无机试剂任选)制备![]() 的合成路线。__________________
的合成路线。__________________
合成路线示意图,如:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是

A. 图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B. 图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C. 图丙是室温下用0.1000 mol·L1NaOH溶液滴定20.00 mL 0.1000 mol·L1某一元酸HX的滴定曲线,说明HX是一元强酸
D. 图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42)的关系曲线,说明溶液中c(SO42 )越大c(Ba2+ )越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种锂钒氧化物热电池装置,电池总反应为xLi+LiV3O8=Li1+xV3O8。工作时,需先引发铁和氯酸钾反应使共晶体熔化,下列说法不正确的是( )
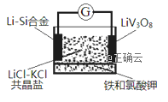
A. 放电时LiV3O8电极反应为:xLi++LiV3O8-xe-=Li1+xV3O8
B. 整个过程的能量转化涉及化学能转化为热能和电能
C. 组装该电池应当在无水、无氧的条件下进行
D. 充电时Cl-移向LiV3O8电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】17.4g MnO2与240 mL 10 mol/L(密度为1.10g/mL)的盐酸(足量)混合加热(不考虑盐酸挥发),使其充分反应后,再向溶液中加入足量的AgNO3溶液。(已知:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O)
MnCl2+Cl2↑+2H2O)
试求:(1)10 mol/L的盐酸的质量分数____________
(2)产生的气体在标准状况下的体积______________;
(3)产生沉淀的质量_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com